
| A. | 100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 向HCOOK和KOH的混合溶液中加入KMnO42KMnO4+HCOOK+KOH═2K2MnO4+CO2↑+H2O | |
| C. | 4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3+Al3+ | |
| D. | 在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
分析 A.根据n=cV计算出碳酸钠的物质的量,然后根据碳酸钠和醋酸的物质的量判断过量情况及反应产物;
B.碱性条件下,反应产物中不会存在二氧化碳气体;
C.设溶液体积为1L,则偏铝酸钠为4mol,HCl为7mol,4mol偏铝酸钠消耗4mol氢离子生成4mol氢氧化铝沉淀,剩余的3mol氢离子溶解1mol氢氧化铝,则反应后生成3mol氢氧化铝、1mol铝离子.
D.反应体系显紫红色,说明而在发生氧化还原反应生成高锰酸根离子.
解答 解:A.100 mL 0.1 mol/L的Na2CO3溶液中含有碳酸钠的物质的量为0.01mol,0.01mol碳酸钠与0.01 molCH3COOH恰好反应生成碳酸氢钠和醋酸钠,反应的离子方程式为:CO32-+CH3COOH═HCO3-+CH3COO-,故A正确;
B.向HCOOK和KOH的混合溶液中加入KMnO4,反应生成碳酸钾,不会生成二氧化碳气体,正确的反应为:2KMnO4+HCOOK+3KOH═2K2MnO4+K2CO3+2H2O,故B错误;
C.4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合,设溶液体积为1L,则偏铝酸钠为4mol,HCl为7mol,4mol偏铝酸钠消耗4mol氢离子生成4mol氢氧化铝沉淀,剩余的3mol氢离子溶解1mol氢氧化铝,则反应后生成3mol氢氧化铝、1mol铝离子,反应的离子方程式为:4AlO2-+7H++H2O═3Al(OH)3+Al3+,故C正确;
D.在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色,说明发生氧化还原反应生成高锰酸根离子,反应的离子方程式为:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O,故D正确;
故选B.
点评 本题考查了离子方程式的正误判断,为高考的高频题,题目难度中等,试题侧重考查反应物过量情况对生成物影响,明确离离子方程式的书写原则为结构件,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步 骤 | 现 象 |
| Ⅰ.将NaCl溶液与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.将Ⅱ中经过滤洗得到的黑色沉淀分成两份,在一份沉淀中加蒸馏水,另一份沉淀中加入NaCl溶液,同时浸泡较长时间. | 加蒸馏水的沉淀仍为黑色,加入NaCl溶液的沉淀变为乳白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
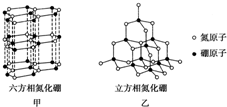 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl、HCl、NaAlO2、NaHCO3 | B. | NaSO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、AlCl3、HNO3 | D. | AgNO3、NaCl、NaSO4、NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | FeO与足量的稀硝酸反应: FeO+2H+═Fe2++H2O | 正确 |
| B | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-═BaSO4↓ | 正确 |
| C | 碳酸氢钠溶液中滴加少量的石灰水: 2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O | 错误,HCO3-、OH-和H2O的系数应均为1,生成物中没有CO32- |
| D | 用食醋除去水瓶中的水垢: CaCO3+2H+═Ca2++H2O+CO2↑ | 错误,醋酸是弱酸,不应写成H+形式 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com