
【题目】I.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时, 涉及如下反应: 2NO(g) +Cl2(g) ![]() 2ClNO(g) ΔH< 0
2ClNO(g) ΔH< 0
写出该反应的平衡常数表达式 。
为研究不同条件对反应的影响,:在恒温条件下, 向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2, 10 min时反应达到平衡。测得10 min内v(ClNO) =7.5×10-3 mol·L-1·min-1, 则平衡后n(Cl2) = mol, NO的转化率α1= 。其他条件保持不变, 反应在恒压条件下进行, 平衡时NO的转化率α2 α1(填“>” “<” 或“=”), 平衡常数K (填“增大” “减小” 或“不变”) 。若要使K减小, 可采取的措施是 。
II. 实验室可用NaOH溶液吸收NO2, 反应为2NO2+2NaOH![]() NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A, 溶液B为0.1 mol·L-1的CH3COONa溶液, 则两溶液中c(NO3-) 、c(NO2-) 和c(CH3COO-) 由大到小的顺序为 。
NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A, 溶液B为0.1 mol·L-1的CH3COONa溶液, 则两溶液中c(NO3-) 、c(NO2-) 和c(CH3COO-) 由大到小的顺序为 。
(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1, CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是 。
a. 向溶液A中加适量水 b. 向溶液A中加适量NaOH
c. 向溶液B中加适量水 d. 向溶液B中加适量NaOH
III.(1)已知丙醛的燃烧热为![]() ,丙酮的燃烧热为
,丙酮的燃烧热为![]() ,试写出丙醛燃烧热的热化学方程式 。
,试写出丙醛燃烧热的热化学方程式 。
(2)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH) 2,装置如右下图所示,其中P端通入CO2。

①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A. X、Y两端都必须用铁作电极 B. 可以用NaOH溶液作为电解液
C. 阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- D. 白色沉淀只能在阳极上产生
【答案】I.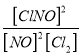 2.5×10-275%> 不变 升高温度
2.5×10-275%> 不变 升高温度
II. c(N![]() ) > c(N
) > c(N![]() ) > c(CH3COO-) b、c
) > c(CH3COO-) b、c
III.(1)![]()
![]() ;
;![]()
(2)①H2-2e-+CO32-=CO2+H2O②BC
【解析】
试题分析:I.该反应的平衡常数表达式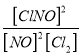 。
。
测得10 min内v(ClNO) =7.5×10-3 mol·L-1·min-1, 则平衡后c(ClNO)= 7.5×10-2 mol·L-1
;n(Cl2) =0.025mol; NO的转化率α1=![]() 75%。其他条件保持不变, 反应在恒压条件下进行, 体积减小,和恒容容器比,相当于加压,平衡正向移动,平衡时NO的转化率增大α2>α1, 平衡常数只与温度有关,温度不变K不变。该反应为放热反应,升高温度,平衡逆向移动,K减小。
75%。其他条件保持不变, 反应在恒压条件下进行, 体积减小,和恒容容器比,相当于加压,平衡正向移动,平衡时NO的转化率增大α2>α1, 平衡常数只与温度有关,温度不变K不变。该反应为放热反应,升高温度,平衡逆向移动,K减小。
II.酸性HNO3> HNO2>CH3COOH,溶液A中NaNO3、NaNO2的浓度均为0.1 mol·L-1,溶液B为0.1 mol·L-1的CH3COONa溶液, 则两溶液中c(NO3-) 、c(NO2-) 和c(CH3COO-) 由大到小的顺序为c(N![]() ) > c(N
) > c(N![]() ) > c(CH3COO-)。
) > c(CH3COO-)。
酸性HNO2>CH3COOH,可使溶液A的PH小于和溶液B的pH,要使PH相等,可以的方法是 :向溶液A中加适量NaOH或向溶液B中加适量水;
III.(1)丙醛燃烧热的热化学方程式![]()
![]() ;
;![]() 。
。
(2)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH) 2,装置如右下图所示,其中P端通入CO2。
①石墨I通入氢气,是电源的负极,电极上的电极反应为H2 - 2e-+ CO32- = CO2+H2O。
②电解法制备Fe (OH)2时,采用金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+;阴极材料可以是铁也可以是其他材料,阴极方程式为: 2H2O+ 2e-= H2↑+ 2OH-,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe (OH)2沉淀,所以可以用NaOH溶液作为电解液也可以不用、阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- ;白色沉淀可能在阳极上产生,也可能在两极之间产生。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题(答题时用具体元素符号表示)。
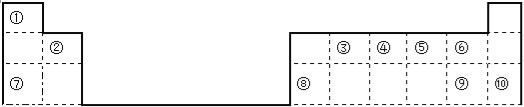
(1)用数字标注的元素中原子半径最小的是 ,半径最大的是 ,化学性质最稳定的是 ,非金属性最强的是 ,最高价氧化物对应的水化物酸性最强的是 。
(2)③最高价氧化物的结构式 ,⑦单质在⑤单质中燃烧产物的电子式
(3)工业制取单质⑦的化学方程式
实验室制取单质⑨的化学方程式
单质⑧与单质⑦的最高价氧化物对应的水化物的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中,正确的是( )
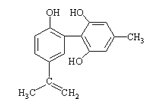
A.滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
B.1mol该物质分别与浓溴水和H2反应时最多消耗溴水和H2分别为4mol和7mol
 C.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
C.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
D.该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫的化合物与人类生活和生产有着密切的联系。请回答下列问题:
(1)在空气质量报告的各项指标中,有SO2和NO2的指数,SO2是一种无色有毒气体,NO2是一种 (填“无色”或“红棕色”)有毒气体;
(2)氨气极易溶于水,其水溶液显 (填“酸”、“碱”或“中”)性;
(3)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出 (填“吸水”、“脱水”或“氧化”)性。
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出 (填“吸水”、“脱水”或“氧化”)性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z是原子序数依次增大的六种常见元素,Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)X在周期表中的位置为______;UW2的电子式为______;X在UW2中剧烈燃烧生成的黑、白两种固体中化学键类型依次是______、______。
(2)U、V、W形成的10电子氢化物中,最稳定的是______(写化学式、下同);沸点最高的是______;结合H+能力最强的是(写化学式)______。
(3)Z3W4与稀盐酸反应的离子方程式为______。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为______,由此可知VW和YW2还原性较强的是(写化学式)______。
(5)已知YW2和Cl2均可使品红溶液褪色,现将一定量的YW2和Cl2通入品红溶液中:
①若品红不褪色,则品红溶液中所发生的化学方程式为______。
②若品红褪色,为证明YW2和Cl2谁过量,最简单的操作、现象、结论是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由合成气制备乙醇一般有两种方法:
(1)直接合成法①2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g) △H1
CH3CH2OH(g) + 3H2O(g) △H1
②2CO(g) +4H2(g) ![]() CH3CH2OH(g) +H2O(g) △H2= -253.6kJ·mol-1
CH3CH2OH(g) +H2O(g) △H2= -253.6kJ·mol-1
(2)间接合成法
合成气反应生成二甲醚(CH3OCH3),二甲醚羰基化合生成乙酸甲酯,乙酸甲酯加氢得到乙醇。其生产流程如下图所示:
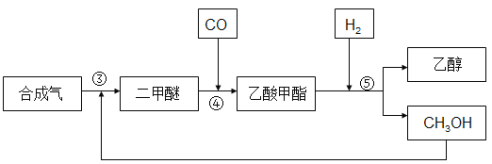
③ 3CO(g) + 3H2(g) ![]() CH3OCH3(g) + CO2 △H3= -260.2kJ·mol-1
CH3OCH3(g) + CO2 △H3= -260.2kJ·mol-1
④ CH3OCH3(g) + CO(g) ![]() CH3COOCH3(g)
CH3COOCH3(g)
回答下列问题:
(1)在5MPa、起始投料量n(H2):n(CO2)=3:1时,测得不同温度时反应①中各物质的平衡组成如图1所示:
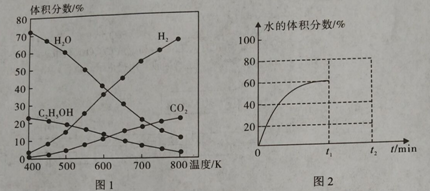
①反应①的△H1 0,△S 0。(填“>”、“<”或“=”)
②已知CO(g) + H2O(g) ![]() CO2(g) + H2(g) △H= -41 kJ·mol-1,则△H1= 。
CO2(g) + H2(g) △H= -41 kJ·mol-1,则△H1= 。
③500K时,反应达到平衡后,在t1min时升温到600K,反应在t2min重新达到平衡,请在图2中画出体系中水的体积分数在t1min后的变化曲线。
(2)对反应③处于化学平衡状态时的描述,正确的是 。(填字母)。
A.CO的含量保持不变 B.容器中CH3OCH3浓度与CO2浓度相等
C.3V正(CO)=V正(CH3OCH3) D.体系的温度保持不变
(3)间接合成法中将甲醇(CH3OH)循环使用的目的是 。
(4)在2Mpa、T℃时1L的恒容容器中,充入1.0mol乙酸甲酯和2.0mol氢气,发生反应⑤,经t min后反应达到平衡,测得乙酸甲酯的转化率为75%。则氢气的反应速率v(H2)= ,平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下面是八种短周期元素的相关信息(已知铍的原子半径为0.089 nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色。
(1)C元素在元素周期表中的位置 。B形成的简单离子的结构示意图 。
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。
(3)用电子式表示A、D形成化合物的过程: 。
(4)H、E形成原子个数比为1∶1的化合物中所含化学键类型为 。
(5)GE2的电子式为 ,F与G形成的最简单的化合物的结构式为 。
(6)E的氢化物比C的氢化物的熔沸点高的原因是 。
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:

(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。通常用来酸化高锰酸钾的酸是
(2)除去滤液1中Cu2+的离子方程式是
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)/![]() <0.7时,滤液1中能够检验出有Fe
<0.7时,滤液1中能够检验出有Fe![]() ;
;![]() ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②③:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②③:
①检验Fe2+是否氧化完全的实验操作是__________。
②生产时H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之间,不宜过大,请从节约药品的角度分析,原因是__________。
③若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的最理想试剂是_(填序号)
a.NaOH溶液 B.铁粉 c.MnO。
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH +3O2→ 2CO2+3H2O,电池示意如图,下列说法正确的是

A. a极为电池的正极
B. 电池工作时电流由a极沿导线经灯泡再到b极
C. 电池负极的电极反应为:4H++ O2+ 4e-= 2H2O
D. 电池工作时,1mol乙醇被氧化时就有12mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com