
| A. | 55% | B. | 60% | C. | 65% | D. | 70% |
分析 标准状况下2.24LH2和Cl2组成的混合气体的物质的量为0.1mol,最终有NaClO生成,说明氢气与氯气反应氯气有剩余,故混合气体中氯气的物质的量大于0.05mol,NaOH的物质的量为0.1L×1.2mol/L=0.12mol,由于HCl与NaOH反应生成NaCl,Cl2与NaOH反应生成NaCl、NaClO,由钠原子与氯原子关系可知,NaOH不足,根据n=cV计算NaClO的物质的量,根据方程式Cl2+2NaOH=NaClO+NaCl+H2O计算与剩余氯气反应的NaOH的物质的量,进而计算与HCl反应的NaOH的物质的量,再计算HCl的物质的量,根据氢元素守恒计算氢气的物质的量,进而计算混合物中氯气的物质的量,据此解答.
解答 解:标准状况下2.24LH2和Cl2组成的混合气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,最终有NaClO生成,说明氢气与氯气反应氯气有剩余,由于氢气与氯气按1:1反应,故混合气体中氯气的物质的量大于0.05mol,NaOH的物质的量为0.1L×1.2mol/L=0.12mol,由于HCl与NaOH反应生成NaCl,Cl2与NaOH反应生成NaCl、NaClO,由钠原子与氯原子关系可知,NaOH不足,反应生成NaClO的物质的量为0.1L×0.2mol/L=0.02mol,根据方程式Cl2+2NaOH=NaClO+NaCl+H2O可知,与剩余氯气反应的NaOH的物质的量为0.02mol×2=0.04mol,
故与HCl反应的NaOH的物质的量为0.12mol-0.04mol=0.08mol,由HCl+NaOH=NaCl+H2O可知,HCl的物质的量为0.08mol,根据氢元素守恒可知氢气的物质的量为$\frac{0.08mol}{2}$=0.04mol,故混合物中氯气的物质的量为0.1mol-0.04mol=0.06mol,氯气的体积分数为$\frac{0.06mol}{0.1mol}$×100%=60%,
故选:B.
点评 本题考查混合物的有关计算,难度较大,根据氯原子与钠原子关系,判断混合气体反应后剩余的氯气与氢氧化钠反应氢氧化钠的量不足是解题关键,为易错题,容易认为剩余的氯气被氢氧化钠完全吸收:


科目:高中化学 来源: 题型:选择题
| A. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第3周期元素氢化物的稳定性顺 序也是:HCl>H2S>PH3 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4,则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | NCl3中N原子是sp3杂化,则BCl3中B原子也是sp3杂化 | |
| D. | 干冰CO2是分子晶体,则SiO2也是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中Ca2+数目减少 | B. | 溶液pH值增大 | ||
| C. | 溶液中c(Ca2+)增大 | D. | 溶液pH值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ•mol-1(反应热) | |
| D. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
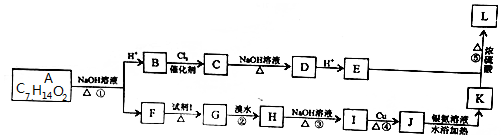
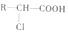
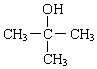 、
、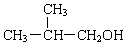 .
.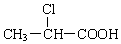 +2 NaOH$→_{△}^{水}$
+2 NaOH$→_{△}^{水}$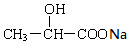 +NaOH+H2O.
+NaOH+H2O.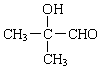 +2 Ag(NH3)2OH$\stackrel{△}{→}$
+2 Ag(NH3)2OH$\stackrel{△}{→}$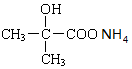 +2 Ag↓+3NH3+H2O.
+2 Ag↓+3NH3+H2O.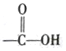
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
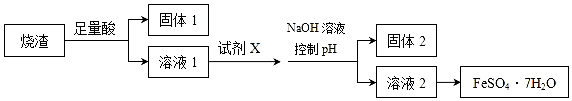
| A. | 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存 | |
| B. | 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成 | |
| C. | 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com