
(1)用铜屑与稀硝酸反应的实验反应速率较慢,为加快反应的速率,可采取的措施是_______________________________________。
(2)铜与稀硝酸反应的离子方程式:_____________________________;
在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是_____________________________;
为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐即可达目的。那么加入碳酸盐的作用是_____________________________。
(3)在做铜与浓硝酸反应的实验时,实验小组为了减少污染,设计了以下四种装置,希望既能观察到反应现象,又能在不拆卸、不增加仪器的情况下使NO2被吸收(注:NaOH溶液可吸收NOx)以避免污染环境。他们设计的装置能达到目的的是___________。(填序号)

(4)实验小组利用上图中的___________装置(填序号),可以在不拆卸、不增加仪器的情况下,用同一装置先后连续完成铜与浓、稀硝酸的反应。要达到此目的,棉球a蘸的物质是___________,液体b为___________。
(1)微热(或加热),用铜粉替代铜屑(答任意一点即可)
(2)3Cu+2![]() +8H+
+8H+![]() 3Cu2++2NO↑+4H2O 试管内有空气存在,将生成的NO氧化为NO2(或2NO+O2
3Cu2++2NO↑+4H2O 试管内有空气存在,将生成的NO氧化为NO2(或2NO+O2![]() 2NO2) 碳酸盐与硝酸反应速率快,生成的CO2排走了试管内的空气
2NO2) 碳酸盐与硝酸反应速率快,生成的CO2排走了试管内的空气
(3)①③ (4)③ NaOH溶液 蒸馏水
解析:(1)影响化学反应速率的内因是反应物本身的性质,外因是反应的温度、接触面积等。由于反应物已经确定,要加快反应速率,只能通过升高温度或增大接触面积的方法加以实现。
(2)起初制一氧化氮时,由于装置内有一定量的空气,空气中有氧气,所以起初生成的一氧化氮总要与氧气反应而使气体呈浅红棕色。要使气体不带有颜色,就要想法去除氧气,常见的为加入少量碳酸盐用产生的气体排除,因为酸与盐的反应比氧化还原反应更容易进行。
(3)四套装置都能完成铜与浓硝酸的反应,并能观察实验现象,但②和④中反应生成的气体无法去除,所以正确答案为①③。
(4)铜与浓、稀硝酸的反应中铜是相同的,但酸中一个为浓硝酸,一个为稀硝酸,要求“不拆卸、不增加仪器”,浓硝酸变为稀硝酸时,只能通过加水来完成,所以只有③可以完成此操作,因为用注射器抽气就可使实验试管内水的倒流。氮的氧化物的吸收,通常用NaOH溶液。


科目:高中化学 来源: 题型:
| A、溶液的导电性与溶液中离子的浓度有关 | B、溶液的导电性与溶液中离子的种类有关 | C、溶液的导电性与溶液中离子的种类和数目有关 | D、往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年贵州省遵义四中高一上学期期末检测化学试卷 题型:单选题
某化学探究性学习小组在探究溶液导电性的实验中发现:往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,而向盐酸溶液中加入少量氢氧化钠固体灯泡的明亮程度没明显变化,他们由此得到了如下一些结论,其中合理的是 ( )
| A.溶液的导电性与溶液中离子的浓度有关 |
| B.溶液的导电性与溶液中离子的种类有关 |
| C.溶液的导电性与溶液中离子的种类和数目有关 |
| D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省安庆市高三第二次模拟理综化学试卷(解析版) 题型:实验题
为检验一批因露置而部分变质的Ba(OH) 2药品的成分,某化学探究性学习小组设计了方案对其进行分析:将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。
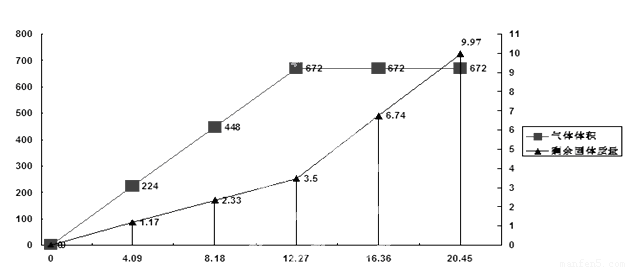
(1) 写出硫酸工业尾气与过量的Ba(OH) 2反应的离子方程式:????????????????????????
(2)提出以下三种合理假设:(已知在空气中Ba(OH) 2很难生成酸式盐)
假设一:药品成分为Ba(OH) 2和BaSO4、BaSO3;假设二:药品成分为Ba(OH) 2和________________;
假设三:药品成分为Ba(OH) 2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
实验操作 | 预期实验现象和结论 |
| 若____________________,假设一成立;
若____________________,假设二成立;
若____________________,假设三成立。 |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
查看答案和解析>>
科目:高中化学 来源:2014届贵州省高一上学期期末检测化学试卷 题型:选择题
某化学探究性学习小组在探究溶液导电性的实验中发现:往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,而向盐酸溶液中加入少量氢氧化钠固体灯泡的明亮程度没明显变化,他们由此得到了如下一些结论,其中合理的是 ( )
A.溶液的导电性与溶液中离子的浓度有关
B.溶液的导电性与溶液中离子的种类有关
C.溶液的导电性与溶液中离子的种类和数目有关
D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com