
| A. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 | |
| B. | 离子半径:M->Z2->Y- | |
| C. | 稳定性:HY<HM | |
| D. | 非金属性:Y>M>Z |
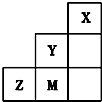
分析 图为元素周期表中短周期的一部分,由元素在周期表的位置可知,X为He,Y为F,Z为S,M为Cl,
A.F没有正价;
B.电子层越多,离子半径越大;具有相同排布的离子,原子序数大的离子小;
C.非金属性越强,氢化物越稳定;
D.同周期从左向右非金属性增强,同主族从上到下非金属性减弱.
解答 解:图为元素周期表中短周期的一部分,由元素在周期表的位置可知,X为He,Y为F,Z为S,M为Cl,
A.F没有正价,则三种元素中,M的最高价氧化物对应的水化物酸性最强,故A错误;
B.电子层越多,离子半径越大;具有相同排布的离子,原子序数大的离子小,则离子半径为Z2->M->Y-,故B错误;
C.非金属性越强,氢化物越稳定,则稳定性:HY>HM,故C错误;
D.同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则非金属性:Y>M>Z,故D正确;
故选D.
点评 本题考查位置结构性质的相互关系及应用,为高频考点,把握元素的位置和性质、元素周期律为解答的关键,注意短周期及X为He为突破口,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | O2、O3 | B. | Na2O、Na2O2 | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | 1H、2H、3H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
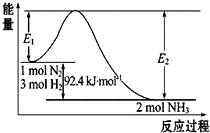 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H5Cl的链状同分异构体有4种(考虑顺反异构) | |
| B. | 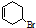 能发生氧化反应、取代反应、加成反应和消去反应 能发生氧化反应、取代反应、加成反应和消去反应 | |
| C. | 分子式符合C4H8O2的酸类和酯类同分异构体共有6种 | |
| D. | 丙烯分子内所有原子都在同一个平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 表中最稳定的共价键是H-F | B. | H2(g)=2H(g)需吸收436kJ的能量 | ||
| C. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | D. | 反应H2(g)+F2(g)=2HF(g)放出25kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4H的电子式为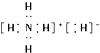 | |
| B. | 1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数的数值) | |
| C. | NH4H中的H-半径比锂离子半径大 | |
| D. | NH4H晶体既有共价键又有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的氨水中有0.1NA个NH4+ | |
| B. | 在标准状况下22.4L SO3有4NA个原子 | |
| C. | 标准状况下,22.4LNO与11.2LO2混合后气体的分子数为2NA | |
| D. | 7.8g Na2S和Na2O2的混合物中所含离子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
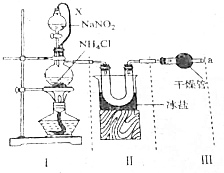 氮气、氨及铵盐用途非常广泛.回答下列问题:
氮气、氨及铵盐用途非常广泛.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com