
下列离子方程式书写正确的是
A. 亚硫酸钠溶液加入稀硝酸:SO32-+2H+= SO2↑+H2O
B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
科目:高中化学 来源:2015届广东省七校高三上学期第一次联考理综化学试卷(解析版) 题型:选择题
下列实验操作不能达到预期实验目的的是
| 实验目的 | 实验操作 |
A | 鉴别CO32-和 SO42- | 分别加入饱和CaCl2溶液 |
B | 比较Al和Fe的金属活动性 | 分别加入浓NaOH溶液 |
C | 比较苯酚和乙酸的酸性 | 分别加入NaHCO3溶液 |
D | 比较AgCl和AgI的溶解度 | 向AgCl的饱和液中加少量KI溶液 |
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:选择题
下列各组离子在溶液中能够大量共存,且加入金属铝后只有氢气放出的是
A.H+、Al3+、Cl‑、SO32- B.Na+、K+、OH‑、[Al(OH)4]-
C.H+、K+、SO42-、NO3‑ D.Na+、NH4+、Cl-、OH‑
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:填空题
(14分)某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母) 。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 | | | | | | |
序号 | A | B | C | D | E | F |
(3)下列情况会使所配溶液浓度偏低的是(填序号)
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如下图所示:
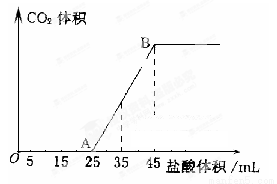
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为__________mL;
②计算所取氢氧化钠溶液的体积V=__________mL。
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为__________________________________,逐渐向反应后的溶液中至少加入1.0 mol L-1的盐酸________ mL才能使生成的沉淀完全溶解。
L-1的盐酸________ mL才能使生成的沉淀完全溶解。
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:选择题
已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液。下列判断不正确的是
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明氧化性:Cr2O72->I2
D.实验③证明H2O2既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:实验题
(13分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
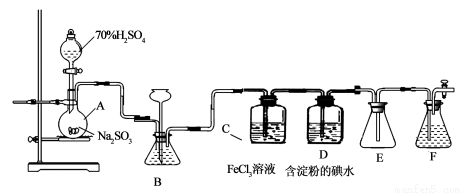
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若
,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
A.蒸馏水 B.饱和Na2SO3溶液
C.饱和NaHSO3溶液 D.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是_________________,写出有关离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:选择题
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3 +3ClO-+4OH- = 2FeO42- +3Cl-+5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
则下列有关说法不正确的是
A.高铁酸钠中铁显+6价
B.湿法中FeO42—是氧化产物
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
(4分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Al3+、Fe3+、SO42―、CO32―、Cl―和I―。你取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中最终无沉淀;
(4)取部分上述碱性溶液,通入过量CO2气体有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;根据上述实验事实,你可知道该溶液中:
① 肯定含有的离子是 ;
② 肯定不存在的离子是 ;
查看答案和解析>>
科目:高中化学 来源:2015届山东省聊城市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列推断正确的是( )
A.SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物
B.Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com