
| n |
| V |
| 1.12L |
| 22.4L/mol |
| 2 |
| x |
| 1 |
| 0.05mol |
| 0.1mol |
| 0.1L |


科目:高中化学 来源: 题型:
| 滴定次数 | 待测液的体积/mL | 0.1000mol?L-1 Na2S2O3的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、Cl-、CO32- |
| B、Cu2+、Cl-、Na+、SO42- |
| C、Ca2+、Na+、Cl-、NO3- |
| D、Fe3+、NH4+、SCN-、HCO3-、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
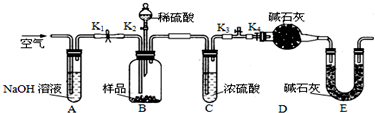
查看答案和解析>>
科目:高中化学 来源: 题型:
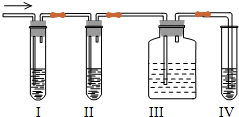
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
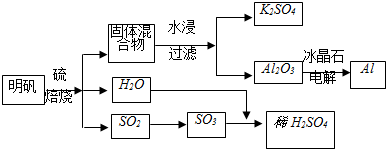
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
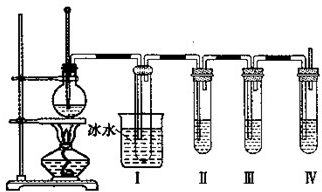 实验室制取乙烯并进行乙烯性质实验的装置如图所示,请回答:
实验室制取乙烯并进行乙烯性质实验的装置如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分相同 |
| B、大豆蛋白、鸡蛋白分别溶于水所形成的分散系为胶体,在加热、甲醛、饱和(NH4)2SO4、X射线作用下,蛋白质的性质都会改变并发生变性 |
| C、棉花和木材的主要成分都是纤维素,蚕丝和羊毛的主要成分都是蛋白质 |
| D、石油裂解和油脂皂化都是高分子生成小分子的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com