
| A�� | ��Na2CO3��Һ�У�c��OH-��-c��H+��=c��HCO3-��+c��H2CO3�� | |
| B�� | 0.2mol•L?1��CH3COONa��Һ��0.1mol•L?1��HCl��Һ�������ϣ���Һ�����ԣ�c��Na+����c��Cl-����c��CH3COO-����c��H+����c��OH-�� | |
| C�� | pH��ͬ��̼������Һ��̼��������Һ��c��NaHCO3����c��Na2CO3�� | |
| D�� | 0.1mol•L?1��HCN�����ᣩ��0.1mol•L?1��NaCN�������ϣ�c��HCN��+c��CN-��=c��Na+�� |
���� A���κε������Һ�ж����ڵ���غ�������غ㣬���ݵ���غ�������غ��жϣ�
B.0.2mol•L?1��CH3COONa��Һ��0.1mol•L?1��HCl��Һ�������ϣ���Һ������Ϊ�����ʵ���Ũ�ȵ�CH3COONa��NaCl��CH3COOH���������̶ȴ��ڴ��������ˮ��̶ȵ�����Һ�����ԣ����������̶Ⱥʹ��������ˮ��̶ȶ���С��
C��̼�������ˮ��̶ȴ���̼���������ˮ��̶ȣ��������ˮ��̶�Խ��pH��ͬ��������ҺŨ��ԽС��
D���κε������Һ�ж����������غ㣬���������غ��жϣ�
��� �⣺A���κε������Һ�ж����ڵ���غ�������غ㣬���ݵ���غ��c��Na+��+c��H+��=2����c��CO32-��+c��HCO3-��+c��OH-�������������غ��c��Na+��=2c��CO32-��+2c��HCO3-��+2c��H2CO3�������Ե�c��OH-��-c��H+��=c��HCO3-��+2c��H2CO3������A����
B.0.2mol•L?1��CH3COONa��Һ��0.1mol•L?1��HCl��Һ�������ϣ���Һ������Ϊ�����ʵ���Ũ�ȵ�CH3COONa��NaCl��CH3COOH���������̶ȴ��ڴ��������ˮ��̶ȣ���c��Cl-����c��CH3COO-����������Һ�����ԣ�����c��H+����c��OH-�������������̶Ⱥʹ��������ˮ��̶ȶ���С����������Ũ�ȴ�С˳����c��Na+����c��CH3COO-����c��Cl-����c��H+����c��OH-������B����
C��̼�������ˮ��̶ȴ���̼���������ˮ��̶ȣ��������ˮ��̶�Խ��pH��ͬ��������ҺŨ��ԽС������pH��ͬ��̼������Һ��̼��������Һ��c��NaHCO3����c��Na2CO3������C��ȷ��
D���κε������Һ�ж����������غ㣬���������غ��c��HCN��+c��CN-��=2c��Na+������D����
��ѡC��
���� ���⿼������Ũ�ȴ�С�Ƚϣ�Ϊ��Ƶ���㣬��ȷ��Һ�����ʼ���Һ������ǽⱾ��ؼ����κε������Һ�ж����ڵ���غ�������غ㣬�״�ѡ����BC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������˵��¶ȷ�Χʱ�Ĵ�Ч������ | |
| B�� | ʹ�ô����������������Ӱٷ������ӿ췴Ӧ���� | |
| C�� | �����ڻ�ѧ��Ӧǰ�������ͻ�ѧ���ʲ�������Ϊ�������μӻ�ѧ��Ӧ | |
| D�� | п�����ᷴӦʱ�����뼸������ͭ��Һ�ɼӿ췴Ӧ���ʣ�������ͭ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
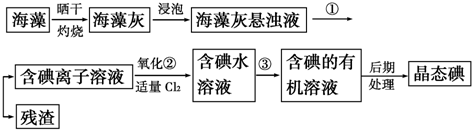
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2��SO32- | B�� | Cl2��HCl | C�� | Na+��Na | D�� | S��SO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Q2=$\frac{1}{2{Q}_{1}}$=98.5 | B�� | Q2=$\frac{1}{2{Q}_{1}}$��98.5 | C�� | Q2��$\frac{1}{2{Q}_{1}}$��98.5 | D�� | ��ȷ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com