

分析 ①甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
②作原电池负极的金属加速被腐蚀;
③原电池工作时,阴离子向负极移动;
④根据氢气和转移电子之间的关系式计算;
解答 解:①A.甲符合原电池构成条件,所以属于原电池,乙不能构成闭合回路,所以不能构成原电池,故A错误;
B.乙不能构成原电池,氢离子在锌片上得电子发生还原反应,所以乙中铜片上没有明显变化,故B正确;
C.甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减少,故C错误;
D.两烧杯中锌和氢离子发生置换反应导致溶液中氢离子浓度减小,所以溶液的pH均增大,故D正确;
故答案为:BD;
②甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙,故答案为:>;
③锌为负极,硫酸根离子向锌极移动过,故答案为:锌;
④甲中,铜电极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,根据电极反应式知,通过电子的物质的量=$\frac{1.12L}{22.4L/mol}$×2=0.1mol,通过导线的电子数目为0.1NA或6.02×1022,
故答案为:0.1NA或6.02×1022.
点评 本题考查原电池设计,侧重考查学生设计及计算能力,会根据得失电子确定原电池正负极、电解质溶液,失电子的金属作负极、得电子的可溶性电解质溶液为该原电池电解质溶液,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
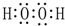 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaOH溶液的量不够 | B. | 加入乙醛太少 | ||
| C. | 加入CuSO4溶液的量不够 | D. | 加入乙醛的量太多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O比H2S稳定,是因为H2O分子间存在氢键 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | 锂所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3 | |
| D. | I的原子半径大于Br,HBr比HI的热稳定性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B A D C E | B. | E C D A B | C. | A B E D C | D. | C D E B A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向1mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 除去甲烷中的乙烯 | 将混合气通入溴水洗气 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有双键 | B. | 一定含有三键 | ||
| C. | 一定含有不饱和键 | D. | 可能含有苯环 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com