
分析 (1)△H小于0的反应为放热反应;
(2)根据反应①的热化学方程式可知,当3mol氢气消耗时,反应的△H=-92.0kJ/mol;
(3)根据反应②的热化学方程式可知,当1mol氧气生成时,反应热△H=+571.6kJ/mol;
(4)根据盖斯定律来分析.
解答 解:(1)反应①的反应热为负值,而△H小于0的反应为放热反应,故反应①为放热反应,故答案为:放热;
(2)根据反应①的热化学方程式可知,1mol氮气和3mol氢气完全反应时,放热92KJ,即当3mol氢气消耗时,反应的△H=-92.0kJ/mol,故答案为:-92;
(3)根据反应②的热化学方程式可知,当2mol液态水分解为2mol氢气和1mol氧气时,吸热571.6KJ,故当1mol氧气生成时,反应热△H=+571.6kJ/mol,故答案为:+571.6;
(4)根据盖斯定律可知,将①×2+②×3可得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=(-92.0kJ/mol)×2+(+571.6kJ/mol)×3=+1530.8KJ/mol,故答案为:+1530.8KJ/mol.
点评 本题考查了反应热的计算和盖斯定律的应用,难度不大,应注意基础的掌握.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 用石灰石与稀盐酸制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应生成白色沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水反应后的溶液显碱性:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 二氧化硅与氢氧化钠溶液反应生成硅酸钠:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
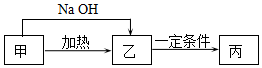 甲、乙、丙3种物质在生产生活中用途广泛,它们均是由短周期元素组成的化合物.甲含有4种元素,其中一种元素原子的最外层电子数是内层的2倍.
甲、乙、丙3种物质在生产生活中用途广泛,它们均是由短周期元素组成的化合物.甲含有4种元素,其中一种元素原子的最外层电子数是内层的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:
化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应均为氧化还原反应 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| D. | 摩尔是七个基本物理量之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | “吹出”采用热空气而不是常温空气的原因是热空气氧化性强 | |
| B. | 碱液吸收所发生的化学反应中氧化剂与还原剂之比为1:5 | |
| C. | 第③步中“酸化”要用强氧化性的酸,如硝酸 | |
| D. | 含溴的水溶液B中的单质溴浓度比A中的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com