
| A、只有Fe2+ |
| B、只有Fe3+ |
| C、只有Fe2+和Cu2+ |
| D、只有Fe3+和Cu2+ |
科目:高中化学 来源: 题型:
A、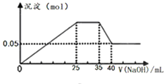 表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2mol?L-1. |
B、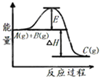 中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时,△H>0,若使用正催化剂,E值会减小. |
C、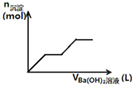 可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
D、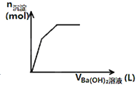 表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
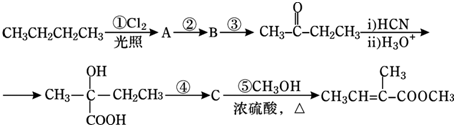
| H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
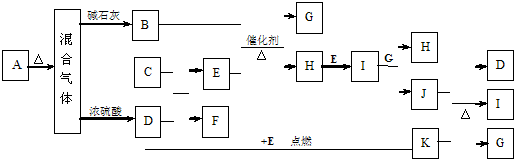
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期律是指元素的性质随着元素相对原子质量的递增而呈周期性变化的规律 |
| B、改变影响化学平衡的一个因素,平衡将向着抵消这种改变的方向移动 |
| C、酸碱质子理论提出凡是能给出质子的物质都是酸,能接受质子的物质都是碱 |
| D、将NH3通入CO2的NaCl饱和溶液中,可生成溶解度较小的NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在空气中燃烧产生黄色火焰,生成淡黄色固体物质 |
| B、新制氯水呈浅黄绿色,氯水放置数天后pH将变大 |
| C、铁与稀盐酸反应生成氯化亚铁,而铁与氯气反应则生成三氯化铁 |
| D、漂白粉的有效成分是次氯酸钙,它具有漂白性是因为在水溶液中生成了有强氧化性的次氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
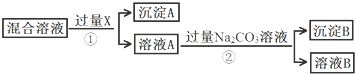
查看答案和解析>>
科目:高中化学 来源: 题型:
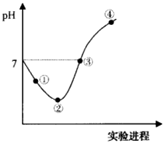 常温下将氯气通入水中至饱和,然后向所得饱和氯水中逐滴滴加0.1 mol?L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )
常温下将氯气通入水中至饱和,然后向所得饱和氯水中逐滴滴加0.1 mol?L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )| A、NaOH与Cl2恰好完全反应时水的电离程度最大 |
| B、实验过程中的pH溶液的不能用pH试纸测得 |
| C、②点之前溶液中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| D、②~③之间所发生反应的离子方程式:Cl2+OH-═Cl-+ClO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com