
| A、2.24LCO2中含有的原子数为0.3NA |
| B、0.1L3mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| C、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
| D、4.5gSiO2晶体中含有的硅氧键数目为0.3NA |
| 4.5g |
| 60g/mol |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、8.7 g |
| B、7.8 g |
| C、16.5 g |
| D、4.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有不同种元素的纯净物叫做化合物 |
| B、水溶液中能电离出H+的化合物一定是酸 |
| C、盐中一定含有金属元素 |
| D、含有氧元素的化合物一定是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
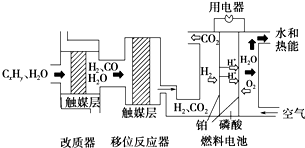 磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )| A、该系统中只存在化学能和电能的相互转化 | ||
B、在移位反应器中,反应CO(g)+H2O(g)
| ||
| C、改质器和移位反应器的作用是将CxHy转化为H2和CO2 | ||
| D、该电池正极的电极反应为O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分散质微粒都能透过半透膜 |
| B、用石墨电极做导电性实验时,分散质微粒都定向且朝一个方向移动 |
| C、都有丁达尔现象 |
| D、都比较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com