
| A. | 导电性 | B. | 延展性 | C. | 高熔点 | D. | 金属光泽 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | W的简单气态氰化物比Y的稳定 | |
| B. | XZ2与QY2中含有j的化学键类型相同 | |
| C. | 元素Q、Y的单质均只存在两种同素异形体 | |
| D. | Y的最高价氧化物对应水化物的酸性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22g由N2O于CO2组成的混合气体中含有的原子数目为1.5NA | |
| B. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| C. | 0.1mol•L-1的AlCl3溶液中含有的Cl-数目为0.3NA | |
| D. | 标准状况下,11.2L水中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
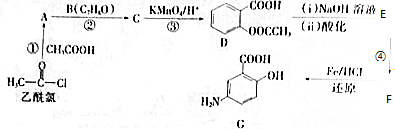

 .
. .
. (写出其中一种结构简式)
(写出其中一种结构简式)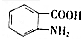 的流程图(无机试剂任选).合成路线流程图如下:
的流程图(无机试剂任选).合成路线流程图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
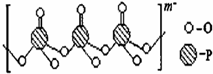 磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(
磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(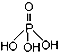 ),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:
),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.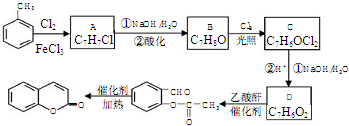
 ,A→B的反应类型是取代反应.
,A→B的反应类型是取代反应. )反应,除生成
)反应,除生成 外,同时生成的另一种产物的结构简式是CH3COOH.
外,同时生成的另一种产物的结构简式是CH3COOH. 互为同分异构体,且具有以下特点:
互为同分异构体,且具有以下特点:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com