
分析 ①根据v=$\frac{△c}{△t}$,转化率=$\frac{转化量}{起始量}$×100%进行计算;
②若改变反应条件,导致CO浓度减小,可以采用改变温度或容器容积的方法;
③根据平衡时浓度,结合平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算其平衡常数,再根据浓度商与化学平衡常数相对大小判断平衡移动方向.
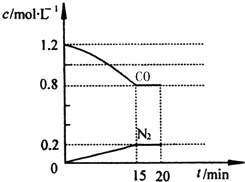
解答 解:①0~15min△C(N2)=0.2mol/L,故0~15min N2的平均速率v(N2)=$\frac{0.2mol/L}{15min}$≈0.013mol/(L•min),
△C(N2)=0.2mol/L,则△C(NO)=2△C(N2)=0.2×2=0.4mol/L,△n(NO)=0.4mol/L×2L=0.8mol,故NO的转化率=$\frac{0.8}{2}$×100%=40%;
故答案为:0.013mol/(L•min);40%;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,但CO浓度增大,故a错误;
b.增加CO的量,平衡向正反应方向移动,但CO的浓度增大,故a错误;
c.降低温度,平衡向正反应方向移动,则CO的浓度减小,故c正确;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,但CO浓度减小,故d正确;
故答案为:cd;
③第一次平衡时c(N2)=0.2mol/L,c(CO)=0.8mol/L,c(CO2)=2c(N2)=0.4mol/L,c(NO)=$\frac{2.0mol}{2}-0.2.mol×2$=0.6mol/L,
化学平衡常数K=$\frac{{c}^{2}(C{O}_{2}).c({N}_{2})}{{c}^{2}(NO).{c}^{2}(CO)}$=$\frac{0.{4}^{2}×0.2}{0.{6}^{2}×0.{8}^{2}}$=$\frac{5}{36}$L/mol,
若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,则c(CO)=0.8mol/L,c(CO2)=0.4mol/L,c(N2)=0.2mol/L+$\frac{0.4}{2}$mol/L=0.4mol/L,c(NO)=0.6mol/L+$\frac{0.4}{2}$mol/L=0.8mol/L,其浓度商Qc=$\frac{0.{4}^{2}×0.4}{0.{8}^{2}×0.{8}^{2}}$=$\frac{5}{32}$L/mol>$\frac{5}{36}$L/mol,则平衡向左移动,温度不变,化学平衡常数不变,
故答案为:向左;$\frac{5}{36}$L/mol.
点评 本题考查化学反应速率的计算、化学平衡移动原理及化学平衡常数的计算,难度较大.要注意利用化学平衡常数与浓度商的关系确定反应方向.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
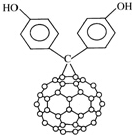 由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )| A. | C60的二苯酚基化合物属于芳香烃 | |
| B. | C60的二苯酚基化合物分子式为C73H12O2 | |
| C. | C60的二苯酚基化合物能与氢氧化钠溶液反应 | |
| D. | 1mol C60的二苯酚基化合物最多可以与6mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,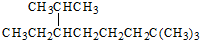 的名称为2,2,7-三甲基-6-乙基辛烷 的名称为2,2,7-三甲基-6-乙基辛烷 | |
| B. | 青蒿素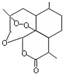 是抗恶性疟疾特效药,其分子式为C15H20O5 是抗恶性疟疾特效药,其分子式为C15H20O5 | |
| C. | 1mol达菲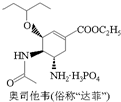 最多能与4molNaOH反应 最多能与4molNaOH反应 | |
| D. | CH3CH=CH-CH=CH2与溴的四氯化碳溶液发生加成反应最多可生成3种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
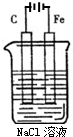 如图是电解NaCl溶液的示意图.请回答下列问题:
如图是电解NaCl溶液的示意图.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
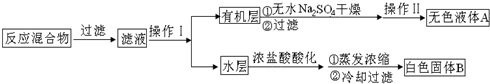
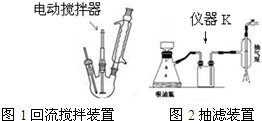
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | iPhone5外壳易掉色原因是,铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| B. | 道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 古代的陶瓷、砖瓦,现代的普通玻璃、水泥都是硅酸盐产品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com