
【题目】下列物质属于电解质的是( )
A.稀硫酸B.酒精C.熔融的氯化钠D.二氧化碳
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某化学小组模拟喷泉实验原理并探究NH3的有关性质。实验过程如下,如图所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。轻轻挤压滴管,使少量水进入烧瓶,打开活塞f。回答下列问题:
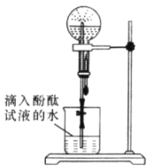
(1)本实验的现象是_________,本实验得到NH3的哪些性质_______
(2)下列可以产生类似现象的组合为____________
a(干燥气体) | b(液体) | ||
A | NO | 水 | |
B | CO2 | 4mol/LNaOH溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 1mol/L盐酸 | |
(3)同温同压下,分别充满①NO2②NH3进行喷泉实验,经充分反应后,圆底烧瓶内溶液的物质的量浓度①_____②(填“<”“>”或“=”)
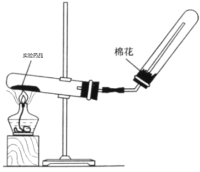
(4)实验室制备氨气的装置如图所示,反应方程式为____________________________,该装置_____(“能”或“不能”)用于加热碳酸氢铵固体来制备纯净的氨气,原因________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
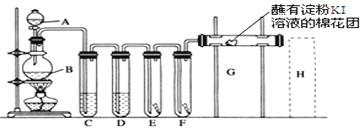
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式___________________。
(2)D中放入浓H2SO4其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论是________________________________。
(4)G处的现象是____________________________________。
(5)用化学方程式写出H处尾气吸收装置中的反应原理____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①消毒液与洁厕灵不能同时使用,原因是(用离子方程式表示)____________。
②需“密闭保存”的原因____________________________________________。
(7)工业上用亚氯酸钠和稀盐酸为原料制备 ClO2 ,写出反应的化学方程式____________。Cl2和ClO2都是强氧化剂,能杀死水中的病菌。等质量的ClO2的氧化能力是Cl2的_______倍。
(8)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,如:[(SCN)2+H2O = HSCN+HSCNO]。它们阴离子的还原性强弱为 Cl-<Br-<CN-<SCN-<I-。试写出:KBr和KSCN的混合溶液中加入(CN)2,反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO![]() 、OH-、Cl-、CO
、OH-、Cl-、CO![]() 、Xn-(n=1或2)中的一种。
、Xn-(n=1或2)中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是_____和_____。
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。
A.Br- B.CH3COO- C.SO![]() D.HCO
D.HCO![]()
(3)将38.4 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D一定含有上述离子中的________(填相应的离子符号),写出Cu溶解的离子方程式____________________________________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是_____________。
(4)E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成环反应在有机合成中具有重要应用,某环状化合物G的合成过程如下:

(1)A→B为加成反应,则B的结构简式是______;B→C的反应类型是______.
(2)G中含有的官能团名称是______;F的化学式为______.
(3)D→E的化学方程式是___________________________________________.
(4)H是F的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O—).H的结构简式是________________.
(5)由C通过加聚反应合成的高分子化合物M的化学方程式为______.
(6)下列说法正确的是______.
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F中均含有2个π键
c.1mol G完全燃烧生成8mol H2O
d.F能发生加成反应、取代反应、氧化反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
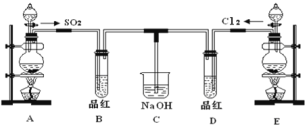
(1)实验室用装置E制备Cl2,其反应的离子方程式为__________________________;若有8mol的HCl参加反应,则转移的电子总数为________。
(2)该装置中氢氧化钠溶液的作用是___________________。
(3)通气后B、D两个试管中的现象______________。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________,D:________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用离子方程式表示)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,试回答以下问题:
I用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度________(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。
II实验室用以下装置进行实验
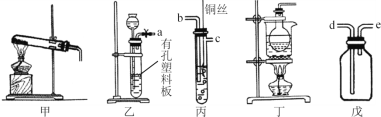
(5)装置甲和戊用于制取并收集少量氨气,甲中发生反应的化学方程式为: ______________________。 戊装置收集氨气应从收集装置的_____(填字母序号)导管进气。
(6)选用装置乙、丙、戊制备、收集一氧化氮气体,乙中塑料板上若放置石灰石,戊中 盛满稀NaOH溶液,仪器正确的连接顺序为________________________ (用接口字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 32 g O2和O3的混合气体所含原子数为NA
B. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
C. 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
D. 在25℃、101kPa下,2 mol氧气和氢气的混合气体的体积约为44.8 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com