
 氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.
氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.分析 (1)粗盐提纯时加试剂的原则是:碳酸钠一定加在氯化钡之后;
碳酸钠与钙离子、钡离子反应分别生成碳酸钙、碳酸钡沉淀;
粗盐水中含有钙离子、镁离子,而电解食盐水生成碱,镁离子、钙离子能够在碱性环境下生成沉淀,堵塞损坏离子交换膜,所以食盐水应进行精制才能进入离子膜电解槽;
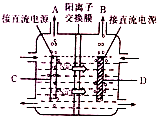
(2)依据图装置分析,钠离子移向D极,说明D为阴极,C为阳极,D电极析出的是氢气;电解氯化钠溶液生成氢氧化钠、氯气和氢气;
(3)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(4)依据转移电子数计算生成NaOH的质量,根据理论耗电量和实际耗电量计算.
解答 解:(1)粗盐提纯,应用氢氧化钠除去镁离子,氯化钡除去硫酸根离子,用碳酸钠除去过量的钡离子,所以碳酸根离子一定放在氯化钡之后,正确顺序为:
NaOH、BaCl2、Na2CO3;或者BaCl2、NaOH、Na2CO3;
碳酸钠与钙离子、钡离子反应分别生成碳酸钙、碳酸钡沉淀,离子方程式:CO32-+Ca2+=CaCO3↓、CO32-+Ba2+=BaCO3↓;
粗盐水中含有钙离子、镁离子,而电解食盐水生成碱,镁离子、钙离子能够在碱性环境下生成沉淀,堵塞损坏离子交换膜,所以食盐水应进行精制才能进入离子膜电解槽;
故答案为:NaOH、BaCl2、Na2CO3或者BaCl2、NaOH、Na2CO3;CO32-+Ca2+=CaCO3↓、CO32-+Ba2+=BaCO3↓;粗盐水中含有钙离子、镁离子,在碱性环境下生成沉淀,堵塞损坏离子交换膜;
(2)依据图装置分析,钠离子移向D极,说明D为阴极,D电极氢离子得到电子发生还原反应生成氢气;
依据图装置分析,钠离子移向D极,说明D为阴极,C为阳极;
电解氯化钠溶液生成氢氧化钠、氯气和氢气,电解方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH;
故答案为:H2;阳极;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH;
(3)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,化学方程式为:Na2SO3+Cl2+H2O=Na2SO4+2HCl,离子方程式为:HSO3-+Cl2+H2O=SO42-+3H++2Cl-,
故答案为:HSO3-+Cl2+H2O=SO42-+3H++2Cl-;
(4)烧碱溶液总含氢氧化钠的实际质量为:1.342×106×113×32%=48.53×106kg;
理论上生成氢氧化钠的质量为:1.492×1.45×104×300×8=51.92×106kg;
该电解槽的电解效率η(NaOH)=$\frac{48.53×1{0}^{6}}{51.92×1{0}^{6}}$×100%=93.46%;
故答案为:93.46%.
点评 本题以氯碱工业为载体,考查了粗盐的提纯,电解饱和食盐水的原理,明确离子反应的实质以及电解池工作原理,准确判断电极及发生反应是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ① | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用容量瓶配制溶液时,必须先用该溶液润洗 | |
| B. | 在蒸馏实验时常加入碎瓷片以防止暴沸 | |
| C. | 可用碱式滴定管量取20.00mLKMnO4溶液 | |
| D. | 分液操作中,待下层液体流出后,再将上层液体从分液漏斗下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H2、2H2--同位素 | B. | HCOOCH3、CH3OCHO--同分异构体 | ||
| C. | S2-、S22---同素异形体 | D. | 甲基丙烯酸、油酸--同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
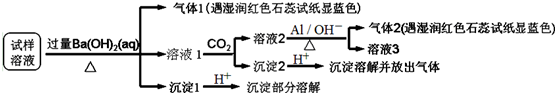
| A. | 试样中肯定存在NH4+、SO42-和NO3-,可能有Mg2+ | |
| B. | 试样中不一定存在Na+、Cl-、HCO3- | |
| C. | 沉淀2中可能含碳酸钡、碳酸镁和氢氧化铝 | |
| D. | 该雾霾中可能存在NaNO3、NH4HCO3和MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
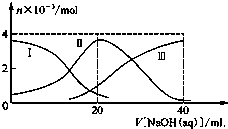 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )| A. | 当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | H2A第一步电离的方程式为H2A→HA-+H+ | |
| D. | 向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液:Mg2+、Fe2+、SO42-、NO3- | |
| B. | 弱碱性溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 使石蕊显紫色的溶液:Al3+、K+、SO42-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com