
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素X与氯形成化合物时,化学式可能是XCl | |
| C. | 元素Y是ⅢA族元素 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
分析 X和Y都是主族元素,I是电离能,X第一电离能和第二电离能相差较大,则X为第IA族元素;
Y元素第三电离能和第四电离能相差较大,则Y是第IIIA族元素,X第一电离能小于Y,说明X活泼性大于Y,
A.主族元素最高正化合价与其族序数相等,但O、F元素除外;
B.由X的化合价可确定氯化物的化学式;
C.Y元素第三电离能和第四电离能相差较大,Y原子核外有3个电子;
D.Al和冷水不反应.
解答 解:X和Y都是主族元素,I是电离能,X第一电离能和第二电离能相差较大,则X为第IA族元素;
Y元素第三电离能和第四电离能相差较大,则Y是第IIIA族元素,X第一电离能小于Y,说明X活泼性大于Y,
A.X第一电离能和第二电离能相差较大,说明最外层1个电子,则化合价为+1价,故A正确;
B.X的化合价为+1价,Cl的化合价为-1价,化学式可能是XCl,故B正确;
C.Y元素第三电离能和第四电离能相差较大,Y原子核外有3个电子,为ⅢA族元素,故C正确;
D.如果Y是第三周期元素,则为Al,Al和冷水不反应,和酸和强碱溶液反应,故D错误.
故选D.
点评 本题考查原子结构与元素周期律知识,为高频考点和常见题型,明确元素电离能与元素所属主族的关系是解本题关键,同时考查学生对物质结构、性质的掌握,注意某些元素性质的特殊性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烯 | ||
| C. | 混合气体中一定有乙烯 | D. | 混合气体中一定有乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一种锌锰干电池外壳的纸层包装印有如图所示的文字,其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加人MnO2氧化吸收H2)
一种锌锰干电池外壳的纸层包装印有如图所示的文字,其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加人MnO2氧化吸收H2)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
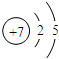 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A组 | B组 | C组 | D组 |
| 金刚石:3550 | Li:181 | HF:-83 | NaCl:801 |
| 硅晶体:1410 | Na:98 | HCl:-115 | KCl:776 |
| 硼晶体:2300 | K:64 | HBr:-89 | RbCl:718 |
| 二氧化硅:1710 | Rb:39 | HI:-51 | CsCl:645 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
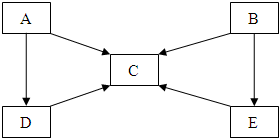 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D、E在常温下都是气体,B为红棕色.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D、E在常温下都是气体,B为红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的液化是物理变化 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 淀粉、蛋白质完全水解的产物互为同分异构体 | |
| D. | 乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
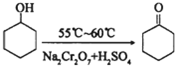
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com