
下列各组离子在指定条件下可能大量共存的是
A. 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-
B. 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C. 常温下水电离出的c(H+)水·c(OH-)水=10-10的溶液中:Na+、Cl-、S2-、SO32-
D. 无色透明溶液:K+、HCO3-、K+、SO42-、Fe3+
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届吉林省长春市高三下学期第二次质量监测理综化学试卷(解析版) 题型:简答题
硫代硫酸钠(Na2S2O3)是一种常用的化工原料,常用作除氯剂等。回答下列问题:
(1)硫代硫酸钠中所含的化学键类型为_______________________。
(2)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,可观察到的现象是________________。
(3)实验测定Na2S2O3溶液呈弱碱性,用离子方程式解释其主要原因:__________,25℃时该离子反应的平衡常数值约为__________________
【已知:25℃时K1(H2S2O3)=2.52×10-1mol/L,K2(H2S2O3)=1.02xl0-2mol/L】
(4)实际生产中,一般将Na2S和Na2CO3以物质的量比2∶1配成溶液后加热,将SO2缓缓通入溶液中,即可得到硫代硫酸钠。反应的化学方程式为_______________________。
(5)在水产养殖上,硫代硫酸钠常用于除去自来水中的氯气,理论上,去除1g的氯需要0.56g硫代硫酸钠。硫代硫酸钠作除氯剂的主要原因是其具有_________性,反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列判断不正确的是( )
A. 电池工作时,电子由铝板沿导线流向铂网
B. 该电池工作时电能转化为化学能
C. 铂电极做成网状,可增大与氧气的接触面积
D. 该电池通常只需要更换铝板就可继续使用
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
邻羟基苯甲酸的结构简式为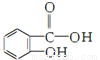 ,俗名水杨酸。水杨酸属于( )
,俗名水杨酸。水杨酸属于( )
A. 氧化物 B. 碱 C. 无机物 D. 有机物
查看答案和解析>>
科目:高中化学 来源:2017届四川省乐山市高三第二次调查研究考试理科综合化学试卷(解析版) 题型:选择题
如图甲是利用一种微生物将废水中的尿素[CO(NH2)2] 的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是
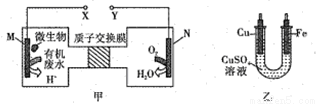
A. 铜电极应与X相连接
B. H+进过质子交换膜由右向左移动
C. 当N电极消耗0.25mol气体时,则铁电极增重16g
D. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
查看答案和解析>>
科目:高中化学 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g)  CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数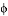 (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g)  CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
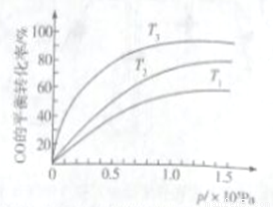
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列有关叙述正确的是
A. 30gNO和30gSiO2中含有的氧原子数均为NA
B. 0.5L2.0mol·L-1NaHSO3溶液中含有的HSO3-数目为NA
C. 标准状况下,5.6LN2与足量的H2反应生成NH3转移的电子数为1.5NA
D. 标准状况下,11.2LNH3与11.2LHCl混合后所得气体中分子数为NA
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三3月质量检测理科综合化学试卷(解析版) 题型:简答题
新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如下:
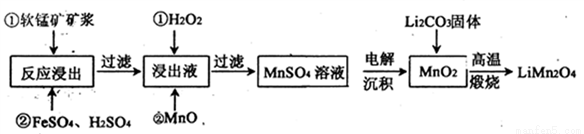
有关物质的溶度积常数
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+= Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为________。
(2)流程中,FeSO4的作用是_______,MnO的作用是_________,当滤液中的pH为6时,滤液中所含铝离子的浓度为___________。
(3)采用下图装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为________;电解产生的MnO2沉积在电极上,该电极反应式为_________。
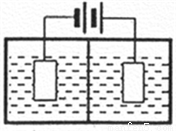
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出。则Fe2+与矿浆中MnO2反应的离子方程式为__________。
(5)写出高温煅烧生成锰酸锂的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A. 氯化钠溶液在电流作用下电离成Na+与Cl?
B. 溶于水后能电离出H+的化合物都是酸
C. 氯化氢溶于水后能导电,但液态氯化氢不能导电
D. 导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com