
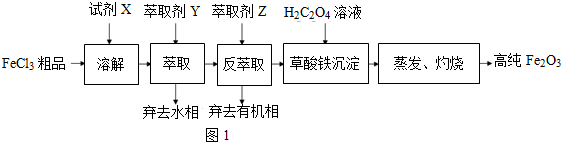
分析 FeCl3粗品(含Ca、Mn、Cu等杂质离子)为原料,试剂X是浓盐酸,HCl(浓)+FeCl3?HFeCl4,加入试剂X为盐酸溶解,以萃取剂Y(甲基异丁基甲酮)萃取法制取弃去水相,加入萃取剂Z分液弃去有机相,得到含铁离子的溶液,加入草酸形成草酸铁沉淀,蒸发灼烧得到高纯氧化铁,
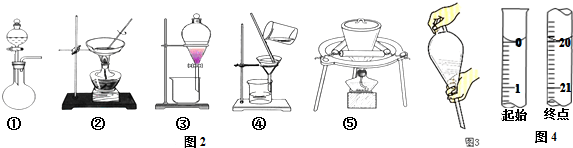
(1)分析可知流程中需要的操作为:溶解、萃取分液、过滤蒸发灼烧,据此分析所需仪器装置;
(2)①根据流程图可知,FeCl3粗品溶于盐酸,得到含有Fe3+、Ca2+、Mn2+、Cu2+等离子的溶液,用Y萃取后再反萃取去掉有机相即可得到较纯的含Fe3+的溶液,所以在萃取时Ca2+、Mn2+、Cu2+应在水相中,、;
②萃取剂X总量一定时,萃取的次数越多,效果越好,据此判断;
③萃取分液操作的注意事项:将液体充分混合均匀;放气的方法为:漏斗倒置,打开旋塞放气;应放置在铁架台上静置;放出液体时应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔,下层液体从下口流出,上层液体从上口倒出;
(3)根据元素守恒可知,萃取后水相中铁的存在形式是氯化铁,用甲基异丁基甲酮萃取时,在有机相中铁元素以形式存在HFeCl4,由于加高纯水时,酸度[或c(H+)]降低,HCl(浓)+FeCl3?HFeCl4平衡向转化为FeCl3的方向移动,所以用高纯水可以进行反萃取;
(4)本实验若用适量Na2C2O4溶液代替H2C2O4溶液会引入杂质钠离子;
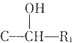
(5)①滴定管是精确量具,读取到0.01ml,利用的是开始和结束时液面差计算得到;
②依据氧化还原反应定量关系计算,6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.
解答 解:FeCl3粗品(含Ca、Mn、Cu等杂质离子)为原料,加入试剂X为盐酸溶解,以萃取剂Y(甲基异丁基甲酮)萃取法制取弃去水相,加入萃取剂Z分液弃去有机相,得到含铁离子的溶液,加入草酸形成草酸铁沉淀,蒸发灼烧得到高纯氧化铁,
(1)分析可知流程中需要的操作为:溶解、萃取分液、过滤蒸发灼烧,据此分析所需仪器,①是气体发生装置,②是溶液蒸发装置,③是分液装置,④是过滤装置,⑤是固体灼烧装置,则没有用到的是①④,
故答案为:①④;
(2)①根据流程图可知,FeCl3粗品溶于盐酸,得到含有Fe3+、Ca2+、Mn2+、Cu2+等离子的溶液,用Y萃取后再反萃取去掉有机相即可得到较纯的含Fe3+的溶液,所以在萃取时Ca2+、Mn2+、Cu2+应在水相中,
故答案为:水相;
②萃取剂X总量一定时,萃取的次数越多,效果越好,实验时分3次萃取并合并萃取液,这样操作的目的是提高萃取率,提高产量,
故答案为:提高萃取率,提高产量;
③A.溶液中加入Y,转移至分液漏斗中,塞上玻璃塞,萃取分液时,加入萃取剂后,应使液体混合均匀,两手分别顶住玻璃活塞,使分液漏斗倒转过来,不能用力振摇,故A错误;
B.振摇几次后漏斗倒置,打开旋塞放气,不需打开分液漏斗上口的玻璃塞放气,故B错误;
C.经几次振摇并放气后,应放置在铁架台上静置,不能手持分液漏斗静置待液体分层,故C错误;
D.分液时,遵循“上吐下泻”原则,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体,故D正确;
故答案为:ABC;
(3)根据元素守恒可知,萃取后水相中铁的存在形式是FeCl3,用甲基异丁基甲酮萃取时,在有机相中铁元素以形式存在HFeCl4,由于加高纯水时,酸度[或c(H+)]降低,HCl(浓)+FeCl3?HFeCl4平衡向转化为FeCl3的方向移动,所以用高纯水可以进行反萃取,
故答案为:A;加高纯水时,c(HCl)降低,平衡向转化为FeCl3的方向移动;
(4)本实验若用适量Na2C2O4溶液代替H2C2O4溶液不合理,采用蒸发、灼烧操作后,反应后生成的氯化钠会残留在高纯氧化铁中,
故答案为:不合理,采用蒸发、灼烧操作后,高纯氧化铁中会有大量NaCl残留在其中;
(5)①滴定起始和终点的液面位置如图如图4,起始量为0ml,结束溶液消耗体积20.00ml,则消耗K2Cr2O7标准溶液体积为20.00ml,
故答案为:20.00;
②6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n 0.1000mol•L-1×0.020L
n=0.012mol,
产品中铁的含量=$\frac{0.012mol×56g/mol}{Wg}$×100%=$\frac{0.672}{W}$×100%,
故答案为:$\frac{0.672}{W}$×100%.
点评 本题考查了物质分离提纯的方法分析,涉及实验基本操作、离子方程式的书写、化学计算等知识,注意反应过程中原子守恒的理解应用,掌握基础是关键,题目难度中等.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
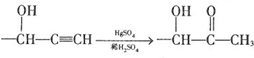
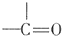 $→_{H_{2}O}^{RNH_{2}}$
$→_{H_{2}O}^{RNH_{2}}$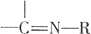
 .
. .
.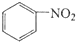 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$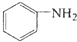 参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体
参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体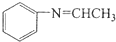 的路线
的路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、糖和醋都可做食品防腐剂 | |
| B. | 青蒿素可以用于治疗疟疾 | |
| C. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2mL0.1mol•L-1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | 滴加KSCN后溶液无明显变化, 加入氯水后溶液变成血红色. |
| Ⅱ | 先向2mL0.1mol•L-1FeCl3溶液中滴加KSCN溶液,再滴加0.1mol•L-1KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加0.1mol•L-1KI溶液后,血红色无明显变化 |
| 编号 | 操作 | 现象 |
| Ⅲ | 向2mL0.1mol•L-1KI溶液中滴加1mL 0.1mol•L-1FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2mL0.1mol•L-1KI溶液中滴加1mL 0.1mol•L-1 FeCl3,溶液变黄色,取该溶液于两支试管中, 试管①中滴加滴加淀粉溶液(或CCl4), 试管②中滴加滴加铁氰化钾溶液. | 预期现象①溶液变蓝 (或溶液分层,下层溶液为紫红色),②出现特征蓝色沉淀. 结论Fe3+能与I-发生氧化还原反应,生成I2和Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| T |
| A. | W、Z、T元素的原子半径及它们的最高价氧化的水化物的酸性均依次递增 | |
| B. | X、Y在自然界中都存在多种同素异形体,其氢化物的沸点一定是后者高 | |
| C. | ZY2、WY2可以形成同种类型的晶体,它们都有杀菌消毒的作用 | |
| D. | 根据元素周期律,可以推测Y、Z、T元素的单质与H2化合时的△H逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
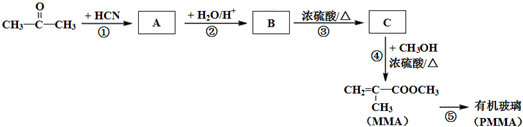
 $\stackrel{+HCN}{→}$
$\stackrel{+HCN}{→}$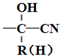
 .
. .
.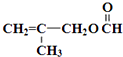
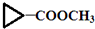
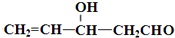
 )”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式)
)”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
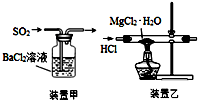
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液 | |
| C. | 用装置甲吸收SO2 | |
| D. | 用装置乙制取无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
| 标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com