
[化学一选修2:化学与技术](15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:

金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在________左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为____________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是____________________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________。
(1)Cu(OH)2+2H+=Cu2++2H2O 3
(2)2 Cu2++2Cl-+Fe=2CuCl↓+Fe2+
(3)加快乙醇和水的蒸发,防止CuCl被空气氧化
(4)Na2SO4和FeSO4 不同温度下硫酸钠和硫酸亚铁的溶解度
(5)2 CuSO4+ Na2SO3+2NaCl+ H2O=2CuCl↓+2 Na2SO4+ H2SO4
OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率。但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率。
【解析】
试题分析:(1)pH=4时铁离子的浓度为0,所以酸浸时主要发生的离子反应是产生的氢氧化铜沉淀和酸的反应,离子方程式是Cu(OH)2+2H+=Cu2++2H2O;根据图像可得,CuCl的产率最高点对应的pH值是3;
(2)Fe、氯化钠、硫酸铜发生反应生成CuCl沉淀,则Cu元素的化合价降低,所以Fe元素的化合价升高,则发生离子的方程式是2 Cu2++2Cl-+Fe=2CuCl↓+Fe2+
(3)因为CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐,所以70℃真空干燥、密封包装的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化;
(4)根据Fe、氯化钠、硫酸铜发生的反应判断,产品滤出时所得滤液的主要分成Na2SO4和FeSO4;若想从滤液中获取FeSO4·7H2O晶体,需将二者分离,所以还需要知道的是不同温度下硫酸钠和硫酸亚铁的溶解度,从而利用溶解度的不同分离二者;
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,则亚硫酸钠起到还原剂的作用,亚硫酸根离子被氧化为硫酸根离子,反应的化学方程式为:2 CuSO4+ Na2SO3+2NaCl+ H2O=2CuCl↓+2 Na2SO4+ H2SO4;
为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率。但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率,所以控制pH至3.5.
考点:考查物质制备流程的分析,反应产物的判断,化学方程式的书写,对图像的分析


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:填空题
100mL 1 mol/LAl2(SO4)3溶液中,Al3+物质的量浓度是 ,含Al3+物质的量 mol,从其中取10ml,Al2(SO4)3物质的量浓度是 ,再将这10ml溶液稀释成100ml,物质的量浓度又为 。Al3+与SO42-物质的量浓度之比是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
下列措施有利于节能减排、改善环境质量的是
①研制开发新型燃料电池汽车,减少机动车尾气污染
②开发推广太阳能、水能、风能等能源
③使用填埋法处理未经分类的生活垃圾
④推广使用燃煤脱硫技术,防治SO2污染
A.①②④ B.①② C.①②③④ D.③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
可用下图所示装置制取、净化、收集气体的是
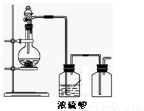
A.锌和稀硫酸反应制氢气
B.浓氨水与氧化钙固体反应制氨气
C.亚硫酸钠固体与较浓硫酸反应制二氧化硫
D.铜与稀硝酸反应制一氧化氮
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.铁在空气中燃烧可生成氧化铁,镁在空气中燃烧可生成氧化镁、氮化镁
B.分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间
C.红宝石、蓝宝石的主要成分是氧化铝,而石英玻璃、分子筛的主要成分是硅酸盐
D.针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐等两两相互反应,并符合离子方程式:
2H++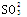 = H2O+SO2↑的化学反应个数有
= H2O+SO2↑的化学反应个数有
A.4 B.5 C.8 D.12
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三上学期期中理综化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数。下列有关叙述正确的是(Fe-56 O-16)
A.标准状况下,2.24LH2O含有的分子数等于0.1NA
B.标准状况下,2.24L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.1NA
C.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
D.18g重水(D2 O)所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列叙述中正确的是
(1)纯铁比碳素钢易生锈
(2)用氨水除去试管上的银镜
(3)硅是制作光导纤维和制造太阳能电池的主要原料
(4)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性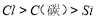
(5)催化剂只能改变反应的活化能,不能改变反应的热效应
(6)用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
(7)同主族元素的简单阴离子还原性越强,水解程度越大
(8)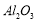 在工业上用于制作耐高温材料,也用于电解法治炼铝
在工业上用于制作耐高温材料,也用于电解法治炼铝
(9)丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
(10)明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视
A.(1)(4)(6)(7) B.(4)(6)(9)(10)
C.(3)(5)(6)(8) D.(5)(6)(8)(9)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com