
| A. | 0.1 mol•L-1(NH4)2SO4溶液:(NH4+)>c(S042-)>c(H+)>(0H-) | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3和NaHCO3等体积混合后的溶液:(Na+)>c(CO32-)>c(HCO3-)>(0H-) | |
| C. | 浓度均为0.1 mol•L-1NH3•H2O和NH4Cl等体积混合后的溶液:c(Cl-)>c(NH4+)>c(NH3•H2O) | |
| D. | 0.1 mol•L-1(Na)2S溶液:(0H-)=c(H+)+c(HS-)+c(H2S) |
分析 A.铵根离子部分水解,溶液呈酸性,则c(H+)>(0H-),由于水解程度较小,则:c(NH4+)>c(S042-);
B.碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-);
C.一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒判断;
D.根据硫化钠溶液中的质子守恒分析.
解答 解:A.0.1 mol•L-1(NH4)2SO4溶液中,铵根离子部分水解,溶液呈酸性,则c(H+)>(0H-),由于水解程度较小,则c(NH4+)>c(S042-),溶液中离子浓度大小为:c(NH4+)>c(S042-)>c(H+)>(0H-),故A正确;
B.由于碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),溶液中正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>(0H-),故B错误;
C.浓度均为0.1 mol•L-1NH3•H2O和NH4Cl等体积混合后的溶液中,一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),根据物料守恒可知:c(Cl-)>c(NH4+)>c(NH3•H2O),故C错误;
D.0.1mol•L-1(Na)2S溶液中,根据质子守恒可得:(0H-)=c(H+)+c(HS-)+2c(H2S),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒、质子守恒的含义为解答关键,注意熟练掌握判断离子浓度大小的常用方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
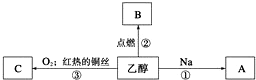
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应已经停止 | B. | 逆反应速率为0 | ||
| C. | 体系温度不再改变 | D. | N2O5已全部转化为NO2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做金属钠与水反应实验时,剩余的钠不能再放入原试剂瓶 | |
| B. | 配制480mLNaOH溶液需要的主要仪器有480mL容量瓶、玻璃棒、烧杯、量筒等 | |
| C. | 将固体药品放在蒸发皿中进行高温焙烧 | |
| D. | 冷凝管中冷却水的流向一定是下口进水、上口出水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于二元酸H2X,若NaHX溶液呈酸性,则H2X为强酸 | |
| B. | 升高温度,Na2A溶液的pH增大,H2A为弱酸 | |
| C. | 向烧碱溶液中通人CO2,一定存在c(Na+)=c(CO32-)+c(HCO3-)+c(H2C03) | |
| D. | 常温下,稀释氢氟酸溶液,$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
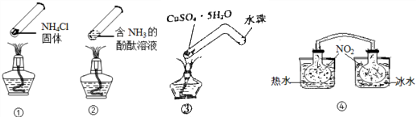
| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl易升华 | |
| B. | 加热时,②溶液颜色变,冷却后又恢复为原来的颜色 | |
| C. | 加热时,③中固体由蓝色变为白色,冷却后又恢复为原来的颜色 | |
| D. | ④中,浸泡在热水中的容器内气体颜色变深,说明受热时反应2NO2?N2O4向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<$\frac{3}{2}$ | B. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<$\frac{1}{2}$ | C. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<4 | D. | $\frac{1}{2}$<$\frac{n(X)}{n(Y)}$<4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com