
分析 (1)电解质:在水溶液中或熔融状态下能够导电的化合物;非电解质:在熔融状态和水溶液中都不能导电的化合物,单质和混合物既不是电解质也不是非电解质;
(2)n=$\frac{m}{M}$计算铁离子的物质的量,在不考虑水解情况下,c(SO42-)=$\frac{3}{2}$c(Fe3+)=$\frac{3}{2}×$$\frac{n(F{e}^{3+})}{V}$,根据稀释定律计算稀释后c(Fe3+),根据m=CVM计算稀释后溶液中Fe2(SO4)3的质量.
解答 解:(1)A.氢氧化钠溶液是混合物,既不是电解质也不是非电解质;
B.液氨溶于水或熔融态时自身不能发生电离,是非电解质;
C.氯化钠晶体溶于水后能够发生电离,溶液导电,是电解质;
D.二氧化碳溶于水或熔融态时自身不能发生电离,是非电解质;
E.硫酸钡熔融态时能够发生电离而导电,是电解质;
因此属于电解质的是CE,属于非电解质的是BD,
故答案为:CE;BD;
(2)100mLFe2(SO4)3溶液中含有Fe3+11.2g,其中铁离子的物质的量n(Fe3+)=$\frac{11.2g}{56g/mol}$=0.2mol,在不考虑水解情况下,c(SO42-)=$\frac{3}{2}$c(Fe3+)=$\frac{n(F{e}^{3+})}{V}$=$\frac{3}{2}×$$\frac{0.2mol}{0.1L}$=3mol/L,
取25mL溶液稀释到100mL,则稀释后溶液中Fe3+的物质的量浓度是c(Fe3+)=$\frac{2mol/L×25ml}{100ml}$=0.5mol/L,稀释后c(Fe2(SO4)3)=$\frac{1}{2}$(Fe3+)=$\frac{1}{2}$×0.5mol/L=0.25mol/L,稀释后溶液中Fe2(SO4)3的质量m=0.25mol/L×0.1L×400g/mol=10g,
故答案为:0.2mol;3mol/L;0.5mol/L;10g.
点评 本题考查电解质和物质的量浓度的计算,为高频考点,题目难度不大,掌握电解质和非电解质的本质区别、溶液浓度的计算和稀释定律是解题关键,解题时不能考虑水解.


科目:高中化学 来源: 题型:解答题

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
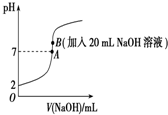 25℃下,向20mL 0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:
25℃下,向20mL 0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6g石墨中的共价键数目 | |
| B. | 常温常压下,17g ND3中所含分子数目 | |
| C. | 0.1mol羟基(-OH)中所含电子数目 | |
| D. | 向0.2mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4++H2O?NH3•H2O+H+ | |
| B. | Al3++3H2O?Al(OH)3+3H+ | |
| C. | CH3COO-+NH4++H2O?CH3COOH+NH3•H2O | |
| D. | HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| C. | 20ml 0.1mol/L CH3COONa溶液与10ml HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com