
| A. | 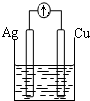 稀硫酸 | B. | 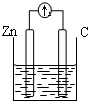 AgNO3(aq) | C. | 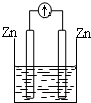 蔗糖 | D. | 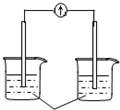 稀硫酸 |
科目:高中化学 来源: 题型:解答题
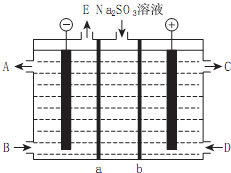
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
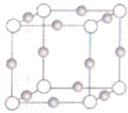 Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.
Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
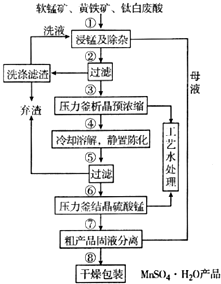 随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题: (3)经查阅资料,生成相应氢氧化物时的pH如表所示.
(3)经查阅资料,生成相应氢氧化物时的pH如表所示.| 化学式 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CDEAB | B. | ECDAB | C. | BAEDC | D. | BADCE |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化石油气、汽油、柴油和润滑油的主要成分都是碳氢化合物 | |
| B. | 可以通过灼烧时的特殊气味来鉴别蛋白质 | |
| C. | 用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 | |
| D. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
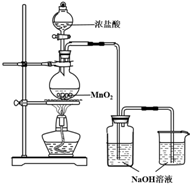 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.| 操作 | 现象 |
| A.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| B. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5ml,pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯和乙烯都能与溴水发生加成反应 |
| B | 乙酸分子中含有羧基 | 可与NaHCO3溶液反应生成CO2 |
| C | 纤维素和淀粉的化学式均为(C6H10O5)n | 它们属于同分异构体 |
| D | 乙酸乙酯和乙烯一定条件下都能与水反应 | 两者属于同一反应类型 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花和蚕丝的主要成分是纤维素 | |
| B. | 蛋白质在一定条件下可以发生水解生成葡萄糖 | |
| C. | 煤的气化是在高温下煤和水蒸汽作用转化为可燃性气体的过程 | |
| D. | 油脂的主要成分是高级脂肪酸甘油酯,在碱性条件下水解可以得到高级脂肪酸和甘油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com