
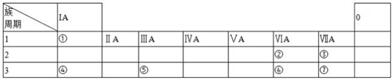
分析 根据元素在周期表中的位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)同周期自左而右元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水;
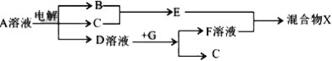
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2,则E为HCl,G能与氢氧化钠溶液反应得到得到氢气与F,故G为Al,F为NaAlO2.
解答 解:根据元素在周期表中的位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Cl>F,故答案为:Na>Cl>F;
(2)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水,反应离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2,则E为HCl,G能与氢氧化钠溶液反应得到得到氢气与F,故G为Al,F为NaAlO2,则:
①D溶液与G反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②检验NaCl溶液中溶质的阴离子的方法:取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成,
故答案为:取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成.
点评 本题考查元素周期表与元素周期律、无机物的推断,难度中等,(4)中关键是根据离子放电顺序理解电解原理判断A物质,注意混合物X与E、F的量有关,需要学生具备扎实的基础.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2C2O4溶液呈碱性:C2O42-+2H2O═H2C2O4+2OH- | |
| B. | AgOH溶解在氨水里:AgOH+2NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | 钢铁发生电化腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 淀粉KI试纸经硫酸酸化后在空气中变蓝:4I-+O2+2H2O═2I2+4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
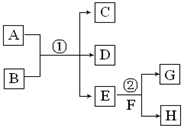 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. (只写一种)
(只写一种)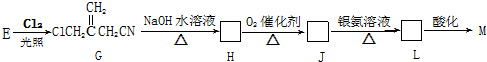


 (实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)
(实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变是指在恒压、恒温下,体系不做体积功,只做其它功的变化过程的热效应 | |
| B. | 书写热化学方程式时若不标明温度和压强,则表示是在0℃、101kpa条件下的反应热 | |
| C. | 化学反应中的能量变化,是由化学反应中化学键断裂时吸收的能量与生成物中化学键形成时放出的能量不同所导致的 | |
| D. | 吸热反应的△H<0,放热反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com