
下列溶液中的c(Cl﹣)与100mL 1mol•L﹣1氯化铝溶液中的c(Cl﹣)相等( )
|
| A. | 300ml 1mol•L﹣1 氯化钠溶液 | B. | 150ml 2mol•L﹣1氯化铵溶液 |
|
| C. | 75ml 3mol•L﹣1 氯化钙溶液 | D. | 120ml 1.5mol•L﹣1 氯化镁溶液 |
| 物质的量浓度.. | |
| 专题: | 物质的量浓度和溶解度专题. |
| 分析: | 电解质离子浓度=电解质浓度×电解质电离出的该离子数目,与溶液的体积无关,100ml1mol/L的 AlCl3溶液中c(Cl﹣)=3mol/L,据此结合计算判断. |
| 解答: | 解:100ml、1mol/L的 AlCl3溶液中c(Cl﹣)=1mol/L×3=3mol/L, A、300ml1mol•L﹣1 氯化钠溶液中c(Cl﹣)=1mol/L×1=1mol/L,与1mol/L的 AlCl3溶液中氯离子浓度不相等,故A错误; B、150ml2mol•L﹣1氯化铵溶液中c(Cl﹣)=2mol/L×1=2mol/L,与1mol/L的 AlCl3溶液中氯离子浓度不相等,故B错误; C、75ml3mol•L﹣1 氯化钙溶液中c(Cl﹣)=3mol/L×2=6mol/L,与1mol/L的 AlCl3溶液中氯离子浓度不相等,故C错误; D、120ml1.5mol•L﹣1 氯化镁溶液中c(Cl﹣)=1.5mol/L×2=3mol/L,与1mol/L的 AlCl3溶液中氯离子浓度相等,故D正确; 故选D. |
| 点评: | 本题考查离子物质的量浓度的有关计算,难度不大,注意电解质离子浓度与电解质浓度关系. |


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
下列混合溶液中,加入过量的氨水产生沉淀,再加入过量的氢氧化钠溶液,沉淀消失的是( )
A.NaCl和MgCl2 B.NaNO3和KNO3
C.K2SO4和Al2(SO4)3 D.MgCl2和AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法不正确的是( )
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验NH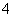 时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的百分含量分别为30.4%和25.9%.若已知甲的分子式是XY2,则乙的分子式只可能是( )
|
| A. | XY | B. | X2Y | C. | X2Y3 | D. | X2Y5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在相应的条件下能大量共存的是( )
|
| A. | 在c(H+)/c(OH﹣)=1×10﹣14的溶液中:NH4+、Ca2+、Cl﹣、K+ |
|
| B. | 水电离的c(H+)=10﹣13mol•L﹣1的溶液中:Fe3+、SO42﹣、K+、SCN﹣ |
|
| C. | 在c(H+)=10﹣14mol/L的溶液中可能含:Na+,AlO22﹣,CO32﹣,SO32﹣ |
|
| D. | c(OH﹣)=1×10﹣14mol/L的溶液中:Na+、K+、Cl﹣、S2O32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要480mL0.1mol/LNa2CO3溶液,现用碳酸钠晶体配制,回答下列问题:
(1)应用托盘天平称取十水合碳酸钠(Na2CO3•10H2O)晶体 g.
(2)本实验还需要的仪器有 .
(3)若实验遇下列情况,溶液的浓度将会(填偏高、偏低、不变)
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.称量的碳酸钠晶体部分失结晶水
(4)请你帮助把标签上的内容写一下(如图).

查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是________。
(3)向水中持续通入SO2,未观察到白雾。推测现象ⅰ的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是________________________________ ________________________________________。
②由实验a、b不能判断白雾中含有HCl,理由是________________________________________________________________________________________________________________________________________________。
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是__________________________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X。
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象ⅲ中黄绿色褪去的原因:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是:( )
A.常温常压下,22.4 L乙烯中C—H键数为4 NA
B.1 mol羟基中电子数为10 NA
C.在反应KIO3+6HI===KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA
D.常温下,1 L 0. 1 mol/L NH4NO3溶液中NH4+的数目小于6.02×1022
查看答案和解析>>
科目:高中化学 来源: 题型:
向1L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,求原溶液中Fe3+的物质的量浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com