
现有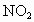 、
、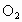 的混合气体12mL,通入足量水中,充分反应后逸出气体2mL(同温、同压下),则原混合气体中含氧气的体积是
的混合气体12mL,通入足量水中,充分反应后逸出气体2mL(同温、同压下),则原混合气体中含氧气的体积是
[ ]
|
A.1.2mL |
B.2.4mL |
|
C.3mL |
D.4mL |
|
解法一:根据有关的反应: 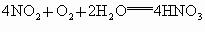 , ,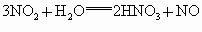 。 。
设原混合气体中 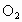 的体积为 的体积为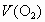 ,剩余气体可能是 ,剩余气体可能是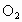 ,也可能是NO。 ,也可能是NO。
①若剩余 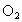 ,则 ,则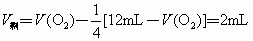
解得 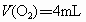 ,D正确。 ,D正确。
②若剩余NO,则 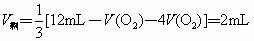
解得 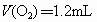 ,A正确。 ,A正确。
解法二:由“参加反应的氮氧化物和氧气中所含氮原子数与氧原子数之比为2:5”列式求解。 剩余气体可能是 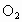 ,也可能是NO,设原混合气体中含 ,也可能是NO,设原混合气体中含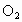 的体积为xmL,则: 的体积为xmL,则:
①若剩余 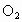 ,则反应的 ,则反应的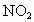 为(12-x)mL,反应的 为(12-x)mL,反应的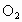 为(x-2)mL,有(12-x)︰[2(x-2)+2(12-x)]=2:5,解得x=4,选项D正确。 为(x-2)mL,有(12-x)︰[2(x-2)+2(12-x)]=2:5,解得x=4,选项D正确。
②若剩余NO(即6mL 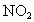 ),则反应的 ),则反应的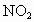 为(6-x)mL,反应的 为(6-x)mL,反应的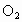 为xmL,有(6-x)︰[2x+2(6-x)]=2:5,解得x=1.2,选项A正确。 为xmL,有(6-x)︰[2x+2(6-x)]=2:5,解得x=1.2,选项A正确。
故正确答案为A、D 规律总结:氮的氧化物溶于水计算的常用方法: (1) 关系式法。①对于 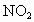 、NO分别与 、NO分别与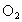 混合与水反应的计算,首先写出以下化学方程式: 混合与水反应的计算,首先写出以下化学方程式:
将以上两式叠加,得以下方程式: 计算时要注意过量判断及剩余气体的成分。 特别提醒:余下的气体一定不是 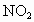 。 。
②NO、 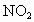 、 、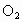 混合溶于水: 混合溶于水:
将以上两式再叠加可得: 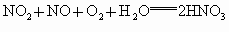
若n(N):n(O)=2:5,则混合气体刚好溶于水;n(N)︰n(O)>2:5,NO过剩;若n(N)︰n(O)<2:5, 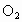 过剩。 过剩。
③NO、 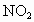 的混合气体缓慢通入过量的NaOH溶液中,发生如下反应: 的混合气体缓慢通入过量的NaOH溶液中,发生如下反应: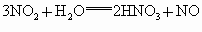 , ,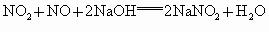 ,将以上两个反应合并得: ,将以上两个反应合并得: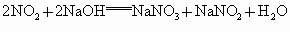
当 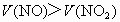 时,反应后剩余NO,体积为 时,反应后剩余NO,体积为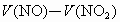 , ,
当 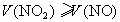 时,最后无气体剩余。 时,最后无气体剩余。
(2) 电子守恒法。当 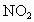 或NO转化为 或NO转化为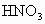 时要失去电子,若上述两种气体与 时要失去电子,若上述两种气体与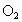 混合后转化为 混合后转化为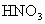 , ,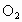 得电子,且得失电子数必然相等,这是电子守恒法解答此类题目的依据。 得电子,且得失电子数必然相等,这是电子守恒法解答此类题目的依据。 |
|
题眼点拨:  、 、 的混合气体通入水中,反应总方程式为: 的混合气体通入水中,反应总方程式为: ,当 ,当 时恰好反应,反应后无气体逸出。现在充分反应后逸出2mL气体,则有两种可能情况,其一:反应后 时恰好反应,反应后无气体逸出。现在充分反应后逸出2mL气体,则有两种可能情况,其一:反应后 过量,再与水反应,最后余下2mL NO;其二:混合气体中 过量,再与水反应,最后余下2mL NO;其二:混合气体中 过量,余下2mL 过量,余下2mL  ,解决问题的思路由此展开。 ,解决问题的思路由此展开。 |


科目:高中化学 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:021
现有O2和NO2的混合气体12 mL,被水充分吸收后,剩余气体2 mL,则原混合气体的组成是
[ ]
查看答案和解析>>
科目:高中化学 来源:2001~2002学年度第二学期形成性练习 题型:021
现有![]() 混合气体12 mL,被水吸收后剩余尾气2 mL,则原混合气的组成是
混合气体12 mL,被水吸收后剩余尾气2 mL,则原混合气的组成是
[ ]
A.![]()
B.![]() 10.8 mL、
10.8 mL、![]() 1.2 mL
1.2 mL
C.![]() 10 mL、
10 mL、![]() 2 mL
2 mL
D.![]() 8mL、
8mL、![]() 4 mL
4 mL
查看答案和解析>>
科目:高中化学 来源:教材完全解读 苏教版课标版 高中化学 必修1 苏教版课标版 题型:021
|
现有NO2、O2的混合气体12 mL,通入足量水中,充分反应后逸出气体2 mL(同温同压下),则原混合气体中含氧气的体积是( ). | |
A. |
1.2 mL |
B. |
2.4 mL |
C. |
3 mL |
D. |
4 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
求反应中被氧化的氨的物质的量。
(1)下面是几位同学从不同角度解答这道题时所列的第一步算式,请你根据这些式子判断,其中未知数x分别代表什么?
甲:22.4 L·mol-1·(x+y)=1.12 L
71 g·mol-1·x+28 g·mol-1·y=3.335 g
答:________________________;
![]()
答:________________________;
![]()
答:________________________。
(2)如设被氧化的氨的物质的量为x,请你写出求算过程,并求出x。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有N2、NH3、NO2组成的混合气体10L.此混合气体通过稀H2SO4时,溶液增重12.5g,混合气体体积减少到3.28L(体积均在标准状况下测定),则此混合气体中三种成分的体积分别是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com