煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H
2O(g)?CO(g)+H
2(g)△H=+131.5kJ?mol
-1①下列措施中,能提高碳的转化率的是
(填字母序号)
a.容器的体积不变,增加水蒸气的物质的量
b.缩小容器的体积,增大压强
c.及时将水煤气从容器中移走
d.其他条件不变,升高温度
②又知C(s)+CO
2 (g)?2CO(g)△H=+172.5kJ?mol
-1则CO(g)+H
2O(g)?CO
2(g)+H
2(g)的焓变(△H)为
.
(2)CO和H
2在一定条件下可反应生成甲醇,CO(g)+2H
2(g)?CH
3OH(g).甲醇是一种燃料,可用于设计燃料电池.如图是甲醇燃料电池的原理示意图.
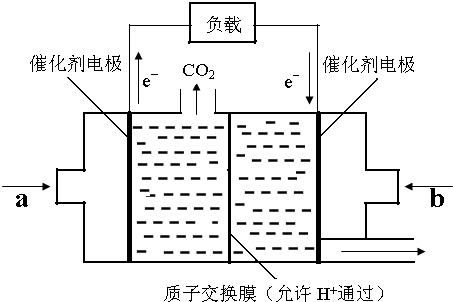
①a处通入的是
(填物质名称),右侧电极上发生
(填“氧化”或“还原”)反应.
②该电池工作过程中,H+的移动方向为从
到
(填“左”或“右”).
③该电池负极反应式为
.
④若用该电池提供的电能电解600ml 0.2mol?L
-1NaCl溶液,设有0.01mol CH
3OH完全放电,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解时阳极反应式为
,电解结束后所得溶液的pH=
.若向电解后的溶液加入适量的醋酸至溶液的pH恰好等于7(反应前后忽略溶液体积的变化),则此时溶液中c(Na
+):c(CH
3COO
-)=
.
(3)在25℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,阴极逸出a mol气体,同时有W g Na
2SO
4?10H
2O晶体析出,若温度不变,此时剩余溶液的质量分数是
(用含字母a、W的代数式表示).




 名校课堂系列答案
名校课堂系列答案

 煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等.
煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等. A、B、C是中学化学中常见的单质,常温下甲、乙两种化合物分别是黑色固体和无色液体,这些化合物和单质之间有如图所示关系.据此判断:
A、B、C是中学化学中常见的单质,常温下甲、乙两种化合物分别是黑色固体和无色液体,这些化合物和单质之间有如图所示关系.据此判断:


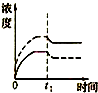
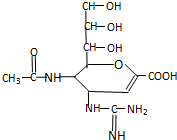 已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性.其分子结构如图:下列说法正确的是( )
已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性.其分子结构如图:下列说法正确的是( )