
分析 (1)硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水;
(2)澄清石灰水中通入过量的CO2气体,反应生成碳酸氢钙;
(3)石灰石的主要成分为碳酸钙,碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水;
(4)氯化铁与铁反应生成氯化亚铁;
(5)铁与稀硫酸反应生成硫酸亚铁和氢气.
解答 解:(1)向H2SO4溶液中逐滴加入Ba(OH)2溶液,反应生成硫酸钡和水,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(2)澄清石灰水中通入过量的CO2气体,反应生成碳酸氢钙,反应的离子方程式为:CO2+OH-=HCO3-,
故答案为:CO2+OH-=HCO3-;
(3)石灰石的主要成分为碳酸钙,碳酸钙与稀盐酸反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(4)FeCl3溶液与Fe反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe═3Fe2+,
故答案为:2Fe3++Fe═3Fe2+;
(5)Fe与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑.
点评 本题考查了离子方程式的书写,题目难度不大,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:解答题
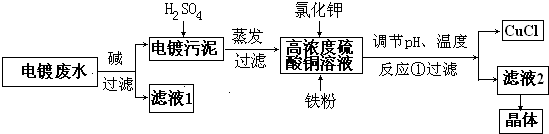

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 没有单质参加的反应一定不是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 化合反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
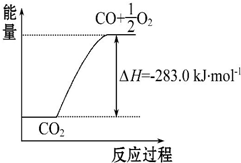 已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1| A. | 通常状况下,氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 由①可知,1 mol CO(g)和$\frac{1}{2}$mol O2(g)反应生成1 mol CO2(g),放出283.0 kJ的热量 | |
| C. | 可用右图表示2CO2(g)═2CO(g)+O2(g)反应过程中的能量变化关系 | |
| D. | 分解1 mol H2O(g),其反应热为-241.8 KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将H2SO4溶液改为浓硫酸 | |
| B. | 用1mol/LH2SO4溶液代替原H2SO4溶液 | |
| C. | 用锌粉代替块状锌 | |
| D. | 用同浓度热的H2SO4溶液代替原H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 | |
| C. | 将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀 | |
| D. | 同物质的量浓度的两种溶液,Na2CO3溶液的碱性强于NaHCO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com