
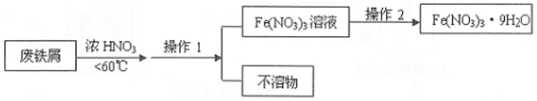
分析 (1)合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质,金属大规模被使用的先后顺序跟金属的活动性关系最大,金属活动性较弱时,比较难形成化合物,常以单质形式存在,比较容易被利用;目前使用量最大的合金是铁合金,钢含碳量少;
(2)铁离子具有强氧化性,可氧化铜,生成亚铁离子和铜离子;
(3)加入过量的Na2O2后,过氧化钠氧化亚铁离子,Al3+转化为偏铝酸根,Mg2+、Fe3+、Cu2+转化为氢氧化物沉淀,灼烧固体得到氧化镁、氧化铜、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+;
(4)①浓硝酸具有强挥发性,且不稳定,在加热条件下能分解生成二氧化氮、氧气和水,根据反应物、生成物和反应条件写出相应的反应方程式;
②磁性氧化铁为四氧化三铁;氧化铁与硝酸反应生成硝酸铁和水;
③通过操作1除去与浓硝酸不反应的物质,从溶液中制取九水合硝酸铁,需蒸发浓缩、冷却结晶,防止结晶水合物分解.
解答 解:(1)金属大规模被使用的先后顺序跟金属的活动性关系最大,金属活动性较弱时,比较难形成化合物,常以单质形式存在,比较容易被利用,铜的活泼性较弱,比较容易冶炼,所以人类最早使用的合金材料是铜合金,目前使用量最大的合金是铁合金;生铁和钢都是铁的合金,生铁中碳的含量在2.0%--4.3%之间,钢中的含碳量在0.03%--2.0%之间,所以D符合,
故答案为:D;
(2)铁离子具有强氧化性,可氧化铜,反应的离子方程式为2Cu+2Fe3+═2Fe2++Cu2+,
故答案为:2Cu+2Fe3+═2Fe2++Cu2+;
(3)过氧化钠具有强氧化性,能氧化亚铁离子,过氧化钠与水反应生成氢氧化钠,加入过量的Na2O2后,Al3+转化为偏铝酸根,Mg2+、Fe3+、Cu2+转化为氢氧化物沉淀,灼烧固体得到氧化镁、氧化铜、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+,与原溶液相比,溶液中大量减少的阳离子是Al3+、Fe2+,
故答案为:BC;
(4)①浓硝酸具有强挥发性,且不稳定,在加热条件下能分解生成二氧化氮、氧气和水,反应方程式为:4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+H2O,
故答案为:4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+H2O;
②磁性氧化铁的化学式为Fe3O4,氧化铁与硝酸反应生成硝酸铁和水,离子方程式为:Fe2O3+6H+═2Fe3++3H2O,
故答案为:Fe3O4;Fe2O3+6H+═2Fe3++3H2O;
③用废铁屑(含Fe和Fe2O3及其它不反应的物质)与浓硝酸反应,通过操作1除去与浓硝酸不反应的物质,从溶液中制取九水合硝酸铁,需蒸发浓缩、冷却结晶,防止结晶水合物分解,
故答案为:过滤;蒸发浓缩、冷却结晶.
点评 本题考查元素化合物性质、物质的制备等,为高频考点,侧重分析与应用能力的考查,注意把握铁铜氮及其化合物的性质、混合物分离方法等,题目难度中等.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
 .下列有关柠檬烯的说法正确的是( )
.下列有关柠檬烯的说法正确的是( )| A. | 该物质常温下为液态,易溶于水 | |
| B. | 它的苯环上的一氯化物有4种 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它可以发生加成、取代、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛装碱性试剂的试剂瓶应该使用橡皮塞 | |
| B. | 分离酒精和水可以采用分液法 | |
| C. | 蒸发结晶时应该将水分全部蒸干 | |
| D. | 在托盘天水左右托盘各放质量大小相同的纸,在左边纸上放氢氧化钠称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 明矾 | 食盐 | 石墨 | 醋酸 |
| D | KOH | CuSO4 | Na2SO4 | KClO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生 | |
| B. | SiO2具有很好的导电性,可用于制取光导纤维 | |
| C. | 节日燃放的烟花,是碱金属、锶、铂、铁等金属化合物焰色反应所呈现的色彩 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com