
【题目】某绿色农药结构简式为 ,回答下列问题。
,回答下列问题。
(1)N元素的基态原子核外有_____种空间运动状态的电子,该农药组成元素中,第一电离能较大的前三种元素是(按由大到小顺序排列)________(用元素符号回答,下同),基态硒原子的价层电子排布式为___________。
(2)该物质中,中心原子杂化轨道类型为sp2的原子有_____,分子中编号为① 的碳原子和与其成键的另外几个原子构成的空间结构为_________。
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三种物质的沸点高低顺序为CH42H63OH,其原因是________,三种物质中属于极性分子的物质是______, 与CH4互为等电子体的一种微粒是_________。
(4)硒化锌的晶胞结构如图所示,则硒的配位数为________,若晶胞边长为d pm ,设阿伏加德罗常数的值为NA,则硒化锌的密度为______(不必化简)。

【答案】 5 F>N>O 4s24p4 N、C 四面体 乙烷的分子量大于甲烷的,所以分子间作用力比甲烷的大,甲醇可形成分子间氢键而乙烷不能 CH3OH NH4+ 4 ![]()
【解析】本题分析:本题主要考查原子结构、分子结构及晶体结构。
(1)一个原子轨道表示一种空间运动状态,N元素的基态原子核外有1s、2s、2px、2py、2pz共5个原子轨道,有5种空间运动状态的电子,该农药组成元素中,第一电离能较大的前三种元素是F>N>O,基态硒原子的价层电子排布式为4s24p4。
(2)该物质中,中心原子价层电子对是3的杂化轨道类型为sp2,这样的原子有C、N,分子中编号为① 的碳原子是单键碳原子,其价层电子对是4,该碳原子与其成键的另外几个原子构成的空间结构为四面体。
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三种物质的沸点高低顺序为CH4<C2H6<CH3OH,其原因是乙烷的分子量大于甲烷的,所以分子间作用力比甲烷的大,甲醇可形成分子间氢键而乙烷不能,三种物质中属于极性分子的物质是CH3OH,等电子体的原子数、价电子数相等, 与CH4互为等电子体的一种微粒可以是NH4+ 。
(4)硒的配位数为4。若晶胞边长为d pm ,设阿伏加德罗常数的值为NA,晶胞含有4个硒原子、4个锌原子,则硒化锌的密度为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是 ( )
A. ρ=(17V+22400)/(22.4+22.4V) B. ω=17c/(1000ρ)
C. ω =17V/(17V+22400) D. c=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制一定物质的量浓度的溶液,一定要用到的一组仪器是( )
A. 托盘天平、药匙、烧杯、容量瓶
B. 量筒(或滴定管、移液管)、容量瓶
C. 容量瓶、烧杯、玻璃棒、胶头滴管
D. 容量瓶、烧杯、玻璃棒、分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化工工业中常用乙苯脱氢的方法制备苯乙烯。已知某温度下:
反应①:CO2(g) +H2 (g)→CO(g) + H2O(g),ΔH= +41.2 kJ/mol
反应②:![]() (g)→
(g)→![]() (g)+H2(g),ΔH= +117.6kJ/mol
(g)+H2(g),ΔH= +117.6kJ/mol
②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式__________________。该反应的化学平衡常数K=_________(用K1、K2表示)。
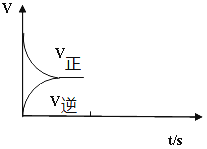
(2)温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注。__________________
Ⅱ.一定条件下,合成氨反应为:如图表示在此反应过程中的能量的变化,如图表示在2L的密闭中反应时N2的物质的量随时间的变化曲线.如图表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
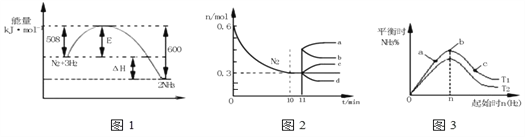
(3)由如图信息,计算10min内该反应的平均速率v(H2)=______,从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为____(填“a”或“b”或“c”或“d”)
(4)如图a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是____点,温度T1____T2(填“>”或“=”或“<”)
Ⅲ.H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示:
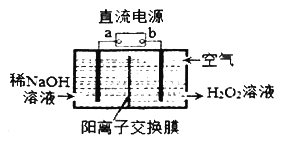
(5)a为______(正极、负极)
(6)通入空气的电极反应式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提溴一般需要经过浓缩、氧化和提取三个步骤。下列对操作步骤描述错误的是
A. 浓缩的原理是蒸发结晶 B. 氧化时通入氯气
C. 提取时利用Br2易挥发 D. 提取时用CCl4萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上烟气脱氮的原理 NO(g) + NO2(g) + 2NH3(g)2N2(g) + 3H2O(g)+Q(Q>0)
(1)该反应化学平衡常数 K 的表达式为_____________________。如果平衡常数 K 值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变
b.容器内气体的压强不变
c.反应消耗 0.5mol NO 的同时生成 1mol N2 d.NO2 的浓度不变
(3)向 2 L 密闭容器中加入反应物,10 min 后达到平衡,测得平衡时气体的物质的量增加了 0.2mol,则用H2O(g)表示的平均反应速率为__________________。
(4)如图是 P1 压强下 NO 的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为P2(P2> P1)下 NO 的转化率随反应时间变化的示意图________________。

(5)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥 NH4Cl。NH4Cl 溶液显_____________性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,溶液中 NH3·H2O、H+、OH-、NH4+、Cl 一浓度由大到小的关系是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以旋转,结构简式为 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 该烃属于苯的同系物
B. 分子中最多有6个碳原子处于同一直线上
C. 该烃的一氯代物有4种
D. 分子中最多有10个碳原子处于同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com