
 在含有4molHCl和1molMgSO4的混合液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法错误的是( )
在含有4molHCl和1molMgSO4的混合液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法错误的是( )| A、a→b时的沉淀的成分只有BaSO4 |
| B、b→c时发生的离子反应为:H++OH-=H2O |
| C、d点时加入的Ba(OH)2物质的量为3mol |
| D、d点后溶液离子的物质的量:Ba2+一定大于OH- |


科目:高中化学 来源: 题型:
| A、在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析出产生沉淀 |
| B、司目戊鼎、定远舰甲板、有机玻璃等原料属于合金 |
| C、聚酯纤维、碳纤维、光导纤维都属于有机高分子材料 |
| D、工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁、均需要石灰石为原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纳米技术的应用,提高了催化剂的催化性能 |
| B、缩小容器体积,平衡向正反应方向移动,CO的浓度减小 |
| C、温度越低,越有利于CO催化加氢 |
| D、从平衡体系中分离出H2O(g)能加快正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
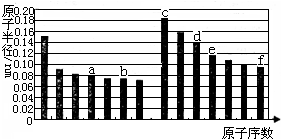
| A、a的单质在高温条件下能置换出e的单质,说明非金属性a<e |
| B、b、d两种元素的离子半径相比,前者较大 |
| C、由b、e两种元素组成的化合物能溶解于强碱溶液,但不能与酸溶液反应 |
| D、由c、d分别与f组成的化合物中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14gC2H4和C4H8的混合气体中所含的共价键数为3NA |
| B、标准状况下,11.2L SO3所含的分子数为0.5NA |
| C、24g3H218O含有的中子数为12NA |
| D、0.1mol O22-所含的电子数为1.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A、T1温度下,500s时O2的浓度为0.74mol?L-1 | ||
B、平衡后其它条件不变,将容器的体积压缩到原来的
| ||
| C、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
| D、T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表为元素周期表的一部分,列出10种元素在周期表中的位置. 用化学符号回答下列问题:
下表为元素周期表的一部分,列出10种元素在周期表中的位置. 用化学符号回答下列问题:| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 第4周期 | ② | ④ | ⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com