
| 1000ρw |
| M |
| n |
| c |
| 1000×1.35×55.8% |
| 98 |
| 0.8mol |
| 7.69mol/L |


科目:高中化学 来源: 题型:
| A、H+、K+、Fe2+、NO3- |
| B、OH-、Cl-、Na+、NH4+ |
| C、Mg2+、K+、Cl-、NO3- |
| D、Ag+、Na+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2、O3 |
| B、H2SO4、H2CO3 |
| C、SO2、NO |
| D、Na2SO3、KClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
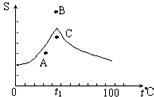 Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )
Na2SO4溶液的溶解度曲线如图,下列说法一定错误的是( )| A、A点表示Na2SO4溶液尚未达到饱和,但降温和加入Na2SO4?H2O晶体都可使其饱和 |
| B、B、C点表示t1℃时,Na2SO4溶液在B点的溶解度大于在C点的溶解度 |
| C、在C点时Na2SO4溶液降温或升温,都会使其溶液变浑浊 |
| D、制取芒硝的最佳方法是在100℃时配成饱和溶液,再降温至0℃析出晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A、上述生成Ni(CO)4(g)的反应为放热反应 |
| B、25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为2×10-5 |
| C、80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L |
| D、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2)?c(CO) |
| c(H2O) |
| n(CH4) |
| n(H2O) |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 光照 |
| 催化剂 |
- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com