
| A. | 电离平衡常数可以表示弱电解质的相对强弱 | |
| B. | 电离平衡常数受溶液浓度的影响 | |
| C. | H2CO3的电离常数表达式:K=$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$ | |
| D. | 电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大 |
分析 A.电离平衡常数等于生成离子浓度幂之积与反应物浓度幂之积的比;
B.电离平衡常数只与温度有关;
C.碳酸是二元弱酸,分步电离;
D.酸溶液中c(H+)与溶液浓度及电离程度有关.
解答 解:A.电离平衡常数等于生成离子浓度幂之积与反应物浓度幂之积的比,电离平衡常数可以表示弱电解质电离程度大小,所以可以表示弱电解质的相对强弱,故A正确;
B.电离平衡常数只与温度有关,与溶液浓度无关,故B错误;
C.碳酸是二元弱酸,分步电离,其第一步电离平衡常数K1=$\frac{c({H}^{+}).c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$,故C错误;
D.酸溶液中c(H+)与溶液浓度及电离程度有关,所以电离常数大的酸溶液中c(H+)不一定比电离常数小的酸中大,故D错误;
故选A.
点评 本题考查电离平衡常数含义及电离平衡常数影响因素等知识点,侧重考查学生对电离平衡常数含义的理解和判断,电离平衡常数只与温度有关,与电解质溶解性及溶液浓度等都无关,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol,则含0.5 mol NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.65kJ | |
| C. | 可燃物的系数为1的燃烧反应的焓变即为该可燃物的燃烧热 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H=a kJ/mol,2C(s)+O2(g)═2CO(g)△H=b kJ/mol,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O=HClO+HSO3- | |
| B. | 用高锰酸钾溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O | |
| C. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
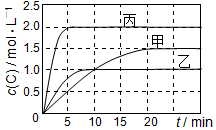 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 平衡后,向甲容器中再充入0.5 mol A,A和B的转化率均增大 | |
| B. | 达到平衡时反应吸收的热量:Q丙>2Q乙 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯. +H2O
+H2O
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉、麻和丝分别属于纤维素、酯类和蛋白质 | |
| B. | 不锈钢餐具属于合金 | |
| C. | 在豆浆中加糖后碗底发现少量晶体状颗粒,这是蛋白质的盐析 | |
| D. | 水的硬度越大,用肥皂洗衣服时效果越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液中先滴足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,说明原溶液中有SO42- | |
| C. | 某溶液中滴加NaOH溶液有蓝色沉淀,说明原溶液中有Fe3+ | |
| D. | 某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com