
分析 (1)碳酸钠溶液中,碳酸根离子部分水解,溶液显示碱性;
(2)CH3COONH4中铵根离子和醋酸根离子的水解程度相当,显示中性,则氢离子和氢氧根离子浓度相等,根据电荷守恒来判断;
(3)根据铵根离子水解平衡移动的影响因素来回答;
(4)醋酸铵显示中性,铵根离子和醋酸根离子的水解程度相当,NH4HCO3溶液呈碱性,则碳酸氢根离子水解程度大于铵根离子的水解程度,据此回答.
解答 解:(1)Na2CO3溶液中,碳酸根离子存在水解平衡:CO32-+H2O?HCO3-+OH-,导致溶液呈碱性,
故答案为:碱;CO32-+H2O?HCO3-+OH-;
(2)CH3COONH4中铵根离子和醋酸根离子的水解程度相当,显示中性,则氢离子和氢氧根离子浓度相等,c(H+)=c(OH-),根据电荷守恒,c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),得到:c(CH3COO-)=c(NH4+),所以c(CH3COO-)=c(NH4+)>c(H+)=c(OH-),
故答案为:c(CH3COO-)=c(NH4+)>c(H+)=c(OH-);
(3)①NH4Cl显示酸性,②CH3COONH4显示中性,③NH4HSO4显示酸性,④氨水(NH3?H2O)显示碱性,属于弱碱,电离出的铵根离子浓度最小,硫酸氢铵电离出的氢离子会抑制铵根离子的水解,醋酸根离子会促进铵根离子的水解,所以四种溶液中c(NH4+)由大到小的顺序是③①②④,
故答案为:③>①>②>④;
(4)醋酸铵显示中性,铵根离子和醋酸根离子的水解程度相当,NH4HCO3溶液呈碱性,则碳酸氢根离子水解程度大于铵根离子的水解程度,所以HCO3-的水解程度比CH3COO-大或HCO3-比CH3COO-结合H+能力强或CH3COOH酸性比H2CO3强,
故答案为:HCO3-的水解程度比CH3COO-大或HCO3-比CH3COO-结合H+能力强或CH3COOH酸性比H2CO3强.
点评 本题考查离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力: CO32-<AlO2- |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度: Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.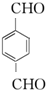 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变温度对反应速率无影响 | |
| B. | 升高温度能加快反应速率 | |
| C. | 使用催化剂能加快反应速率 | |
| D. | 该反应的化学方程式为:2CO+2NO═N2+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液、胶体、浊液属于不同的分散系 | |
| B. | 胶体与其他分散系的本质区别是胶体分散质粒子直径在1nm-100nm之间 | |
| C. | 可利用丁达尔现象鉴别溶液和胶体 | |
| D. | 利用过滤的方法可以分离胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
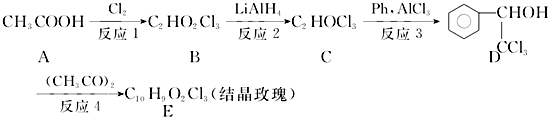
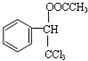 .
.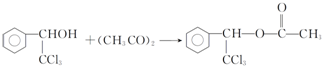 .
.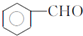 ,F与氯仿合成D的反应方程式为
,F与氯仿合成D的反应方程式为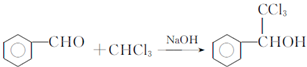 .已知2分子F在KCN存在下可通过授受H反应生成安息香
.已知2分子F在KCN存在下可通过授受H反应生成安息香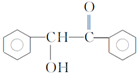 ,请写出上述反应方程式
,请写出上述反应方程式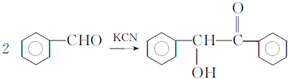 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
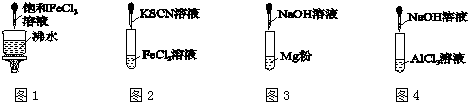
| A. | 图1产生红褐色沉淀 | |
| B. | 图2溶液颜色变红 | |
| C. | 图3放出大量气体 | |
| D. | 图4先出现白色胶状沉淀,后沉淀溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com