
氧化还原反应概念正误判断,正确的打“√”,错误的打“×”
(1)有化合价升降的化学反应一定是氧化还原反应( )
(2)置换反应全部属于氧化还原反应,因为有单质参加和生成,化合价发生了变化( )
(3)氧化还原反应一定属于四大基本反应类型( )
(4)有单质参加或生成的化学反应一定是氧化还原反应( )
(5)氧化还原反应中,反应物不是氧化剂就是还原剂( )
(6)在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质( )
(7)在氧化还原反应中,非金属单质都做氧化剂( )
(8)生成物中来源于氧化剂的是还原产物( )
(9)还原剂具有还原性,反应时本身被还原,发生还原反应( )
(10)元素从化合态变为游离态,该元素不一定被还原( )
(11)失电子越多,还原性越强,得电子越多,氧化性越强( )
(12)在同一氧化还原反应中,氧化剂的氧化性一定大于氧化产物的氧化性( )
(13)金属元素被还原,不一定得到金属单质( )
(14)含氧酸的价态越高,氧化性一定越强( )
(15)不容易得到电子的物质,肯定容易失去电子( )
科目:高中化学 来源: 题型:
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法错误的是 )。
| 物质 | X | Y | Z | W |
| 初始浓度/mol·L-1) | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol·L-1) | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=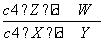
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化: ;
b. 沉淀: ;
c. 分离,洗涤; d. 烘干,研磨。
查看答案和解析>>
科目:高中化学 来源: 题型:
在图(1)中A、B两个容器里,分别收集着两种不同的理想气体。若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是( )
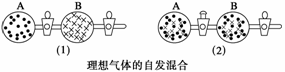
A.此过程是从混乱程度小向混乱程度大变化的过程,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程是从有序到无序,混乱度增大的过程
D.此过程是自发可逆的
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、101 kPa下,ΔH=-113 kJ·mol-1、ΔS=-145 J·mol-1·K-1。下列说法中错误的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂
C.该反应常温下能自发进行,高温和催化剂只是加快反应的速率
D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
①②]次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2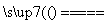
 +2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
A.方框中的物质应为Cu2S
B.该反应的部分产物可用于硫酸工业
C.反应中SO2既是氧化产物又是还原产物
D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A.开始加入合金的质量可能为16.4 g
B.参加反应的硝酸的物质的量为0.1 mol
C.生成沉淀完全时消耗NaOH溶液的体积为100 mL
D.标准状况下产物NO的体积为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com