
| A. | 1.0 mol•L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液:NH4+、Ca2+、Cl-、NO3- | |
| C. | pH=1的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | 由水电离产生c(H+)=10-10mol/L的溶液:NH4+、Ca2+、AlO2-、S2- |
分析 A.酸性条件下NO3-具有强氧化性;
B.$\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液呈酸性;
C.pH=1的溶液呈酸性;
D.由水电离产生c(H+)=10-10mol/L的溶液可能呈酸性或碱性.
解答 解:A.酸性条件下NO3-具有强氧化性,具有还原性的Fe2+不能大量共存,故A错误;
B.$\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液呈酸性,离子之间不发生任何反应,可大量共存,故B正确;
C.pH=1的溶液呈酸性,酸性条件下Ag(NH3)2+不能大量共存,故C错误;
D.由水电离产生c(H+)=10-10mol/L的溶液可能呈酸性或碱性,酸性条件下AlO2-、S2-不能大量共存,碱性条件下NH4+不能大量共存,故D错误.
故选B.
点评 本题考查离子共存的判断,为高考的高频题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,难度不大.


科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入3mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入3mL 5% H2O2溶液和3mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
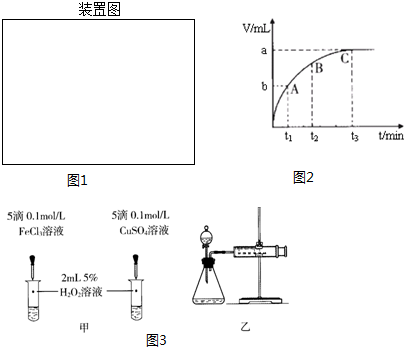
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4和Ba(OH)2 | B. | CO2和NaOH | C. | CaCO3和HCl | D. | Mg(OH)2和CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶液稀释到原体积的2倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2 mol•L-1盐酸 | D. | 加少量冰醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
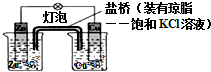
| A. | 正极表面出现气泡 | B. | 电池反应:Zn+Cu2+=Zn2++Cu | ||
| C. | 在外电路中,电流从负极流向正极 | D. | 盐桥中K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠固体 | B. | 少量锌粉 | C. | 硫酸钾溶液 | D. | 盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com