
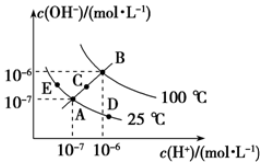
 已知水的电离平衡曲线如图所示,
已知水的电离平衡曲线如图所示,分析 (1)水的离子积常数只与温度有关,温度越高,离子积常数越大;
(2)从A点到D点c(H+)变大,c(OH-)变小,但Kw不变;
(3)E对应的温度下,Kw=10-14,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则酸溶液中的n(H+)等于碱溶液中的n(OH-),据此计算;
(4)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的pH1与强碱的pH2之间应满足的关系.
解答 解:(1)水的离子积常数只与温度有关,温度越高,离子积常数越大,同一曲线是相同温度,根据图知,温度高低点顺序是B>C>A=D=E,所以离子积常数大小顺序是B>C>A=D=E,
故答案为:B>C>A=D=E;
(2)在A点时,c(H+)=c(OH-),溶液显中性,而到D点c(H+)变大,c(OH-)变小,溶液显酸性,即由A点到D点,溶液由中性变为酸性,但Kw不变.
a、升高温度,Kw变大,故a错误;
b、加入少量盐酸,则溶液显酸性,氢离子浓度增大,氢氧根离子浓度减小,故b正确;
c、加入氯化铵,水解显酸性,且Kw不变,故c正确.
故选bc,
故答案为:bc;
(3)E对应的温度下,Kw=10-14,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则酸溶液中的n(H+)等于碱溶液中的n(OH-),故有:
10-5mol/L×V碱=10-4mol/L×V酸,解得:$\frac{{V}_{碱}}{{V}_{酸}}$=$\frac{10}{1}$,故答案为:10:1;
(4)要注意的是95°C时,水的离子积为10-12,即酸、碱浓度相等时pH(酸)+pH(碱)=12,现强碱的OH-浓度是强酸H+浓度的100倍,所以pH(酸)+pH(碱)=14,即pH1+pH2=14,或a+b=14,
故答案为:a+b=14(或pH1+pH2=14).
点评 本题考查酸碱混合的定性判断和溶液PH的有关计算,题目难度中等,注意酸碱混合时酸碱物质的量的关系以及溶液PH与c(H+)、(OH-)的关系.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室需用480mL、0.1mol/L的CuSO4溶液,应选用500mL容量瓶,称取12.5g胆矾 | |
| B. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗净后,需要用待测溶液润洗2-3次 | |
| C. | 溶解固体溶质或稀释溶液时,未冷却至室温即转入容量瓶进行定容 | |
| D. | 用标准浓度的NaOH 溶液滴定未知浓度的稀盐酸,碱式滴定管用蒸馏水润洗后不需要用标准溶液润洗2--3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器里P、Q、R、S四种物质共存 | |
| B. | 容器里气体总物质的量不再改变 | |
| C. | 容器内气体压强、密度不随时间变化 | |
| D. | 单位时间内生成nmol P同时生成nmol S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol X2,同时生成n mol XY | |
| B. | 单位时间内生成n mol X2,同时生成n mol Y2 | |
| C. | 单位时间内生成2n mol XY,同时生成n mol Y2 | |
| D. | 容器内总压强不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7 | B. | 6 | C. | 5 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 糠醛(
糠醛(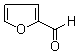 )可与新制含有NaOH的Cu(OH)2悬浊液在加热条件下反应得到砖红色沉淀Cu2O.
)可与新制含有NaOH的Cu(OH)2悬浊液在加热条件下反应得到砖红色沉淀Cu2O. 分子中含有σ键的数目为11mol.
分子中含有σ键的数目为11mol. 分子中碳原子轨道的杂化类型是sp2.
分子中碳原子轨道的杂化类型是sp2. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$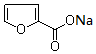 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)→H2O(1)+44.0kJ | B. | 2HI(g)→H2(g)+I2(g)-9.4kJ | ||
| C. | 浓硫酸溶于水 | D. | 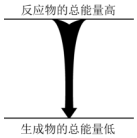 能量变化如图所示的化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com