
【题目】已知K、Ka、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合所得溶液中,c(NH4+)=c(Cl-)则溶液显__________(填"酸""碱"或"中")性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=__________;
(2)25℃,H2SO3![]() HSO3-+H+,其电离平衡常数Ka=1×10-2 mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=__________;
HSO3-+H+,其电离平衡常数Ka=1×10-2 mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=__________;
(3)高炉炼铁中发生的反应有:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH<0
Fe(s)+CO2(g) ΔH<0
①该反应的平衡常数表达式K=__________;
②已知1100℃时,K=0.25,则平衡时CO的转化率为__________;
③在该温度下,若测得高炉中c(CO2)=0.020mol/L,c(CO)=0.1 mol/L,则此时反应速率v正__________(填">""<"或"=")v逆
【答案】中 ![]() 0.01mol/L
0.01mol/L ![]() 20% >
20% >
【解析】
所得混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(H+)+c(NH4+)=c(Cl-)+c(OH-),则c(H+)= c(OH-),溶液呈中性;在NH3H2O![]() NH4++ OH-,n(Cl-)=0.01 mol/L÷2=0.005mol/L,根据电荷守恒可知:c(NH4+)=c(Cl-)=0.005mol,根据物料守恒c(NH3H2O)=(0.5a-0.005)mol/L,溶液显中性, c(OH-)=1)-7mol/L, NH3H2O的电离常数Kb=
NH4++ OH-,n(Cl-)=0.01 mol/L÷2=0.005mol/L,根据电荷守恒可知:c(NH4+)=c(Cl-)=0.005mol,根据物料守恒c(NH3H2O)=(0.5a-0.005)mol/L,溶液显中性, c(OH-)=1)-7mol/L, NH3H2O的电离常数Kb=![]() ;
;
(2) H2SO3![]() HSO3-+H+,电离平衡常数Ka=1×10-2mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=
HSO3-+H+,电离平衡常数Ka=1×10-2mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=![]() mol/L;
mol/L;
(3) ①高炉炼铁中发生的反应有:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ,该反应的平衡常数表达式K=
Fe(s)+CO2(g) ,该反应的平衡常数表达式K=![]() ;
;
②已知1100℃时,K=0.25,假设开始时CO物质的量浓度为1,平衡时CO2浓度为x,则平衡时CO的浓度为(1-x),根据K=![]() ,解得x=0.2,所以CO的平衡转化率为(0.2÷1)×100%=20%;
,解得x=0.2,所以CO的平衡转化率为(0.2÷1)×100%=20%;
③在该温度下,若测得高炉中c(CO2)=0.020mol/L,c(CO)=0.1 mol/L,则Qc=![]() <0.25,说明反应正向进行,未达到平衡,所以V正>V逆。
<0.25,说明反应正向进行,未达到平衡,所以V正>V逆。


科目:高中化学 来源: 题型:
【题目】某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2 溶液 | 无 |
② | 10 mL 5% H2O2 溶液 | 无 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。
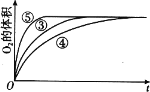
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
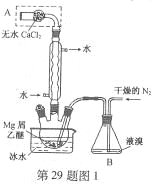
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
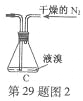
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品 | B.洗涤晶体可选用0℃的苯 |
C.加热至160℃的主要目的是除去苯 | D.该步骤的目的是除去乙醚和可能残留的溴 |
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-="===Mg" Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量的说法中错误的是( )
A. 化学反应必然伴随着能量变化
B. 油脂在人体中氧化是放热反应
C. 镁与盐酸反应是吸热反应
D. 氢分子(H-H)变成2个H需吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息填空。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。负极反应式为________________反应一段时间后负极的质量_________(填“增重”或“减少”或“不变”)
(2)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,该电池极的负电极反应式是:_____________________;正极电极反应式_______________
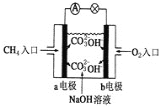
(3)将铝片和铜片用导线相连,分别插入浓硝酸中(a组)和插入烧碱溶液中(b组),都形成了原电池,在a组原电池中,负极材料为___________;写出b组插入烧碱溶液中形成原电池的负极反应式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
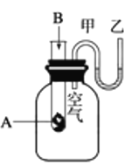
(1)该反应为____________反应(填“放热”或“吸热”)。
(2)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(3)写出一个符合题中条件的化学方程式:_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分:
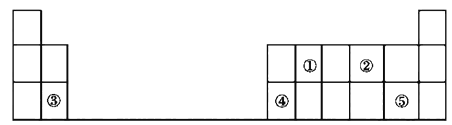
(1)①表示的元素名称是____,②对应简单离子结构示意图为_____,简单离子半径比较②______④。(填“大于”、“小于”、“等于”)
(2)③位于元素周期表第__________周期第__________族。
(3)④的单质与NaOH溶液反应的离子方程式_______________。
(4)用电子式表示③和⑤形成化合物的过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关橡胶的说法不正确的是( )
A.橡胶均具有高弹性
B.橡胶有天然橡胶和合成橡胶两种
C.天然橡胶的化学成分是聚异戊二烯
D.构成橡胶的高分子链在无外力作用时呈直线状
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com