
在下列溶液中,各组离子一定能够大量共存的是
A.常温下水电离出的c(OH-)=10-13的溶液中:Na+、ClO-、F-、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO 、S2-、SO
、S2-、SO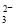
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014江苏省泰州市姜堰区高二下学期期中考试 化学试卷(解析版) 题型:选择题
对某未知有机物进行研究:称取该样品0.352 g,通入足量氧气流充分燃烧,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重0.144g和0.528g,生成物完全被吸收。下列说法错误的是
A.未知物中碳的质量分数是 41% B.未知物中含有C、H、O元素
C.未知物的实验式为C3H4O3 D.已有条件可确定未知物的分子式为C6H8O6
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ + SO42- =BaSO4↓
C.氨水和硫酸铝溶液反应:3OH-+ Al3+ =Al(OH)3↓
D.二氧化硅与氢氧化钠溶液反应 SiO2+2OH-=SiO32-+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
T ℃时,某NaOH溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如表中所示:
序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱。由此判断下列说法正确的是
A.金属镁的熔点高于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐升高的
C.金属镁的硬度小于金属钙
D.金属铝的硬度大于金属钠
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:填空题
NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1) 第一步生产过程中发生反应的总化学方程式是 。
(2) 检验NaNO3成品中是否含少量的Na2CO3杂质的方法是
(3) 生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4) 生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积为多少m3(标准状况下)。请写出计算过程。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性
C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
D.汽车尾气的净化反应2NO+2CO 2CO2+N2 △H<0,则该反应一定能自发进行
2CO2+N2 △H<0,则该反应一定能自发进行
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
在一个容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生反应:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
实验测得在300℃和500℃时,甲醇的物质的量(mol)随时间的变化如下表所示。
| 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
下列说法正确的是
A.该反应的ΔH>0,升高温度,化学平衡常数K增大
B.300℃时,前20 min内的反应速率v(H2)=0.003 mol·L-1·min-1
C.采取加压、增大c(H2)、加入合适的催化剂等措施都能提高CO的转化率
D.500℃时,在起始时向容器中加入0.1 mol CO和0.3 mol H2,可计算出反应达平衡后甲醇的浓度
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
A.R的原子半径比Z的大
B.R的氢化物的热稳定性比W的强.
C.X与Y形成的化合物只有一种
D.Y的最高价氧化物的水化物的酸性比W的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com