
为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液、直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),通过巧妙的构思,设计了比较铜、锌金属活动 性相对强弱的系列实验。试填写下列空白:
性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),向烧杯中小心加入稀硫酸,观察到的现象是________。甲同学的设计思路是_____________________________。
(2)乙同学接着甲的实验,向烧杯中滴加________溶液,进而观察到的现象是____________________________________________________________ ____________。
____________。
乙同学作出锌、铜金属活动性相对强弱的结论所依据的原理是____________________________________________________________________。
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂________ 溶液(作为电解液)。反应在调控下随即开始,实验中有关反应的化学方程式为________________________。实验中的明显现象是____ ____________________。
____________________。
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌、铜金属活动性的相对强弱(简要说明操作和现象)______________________________。
解析:从该题的实验目的来看,是要用实验证明锌和铜的金属活动性的相对强弱;从实验方法来看,有与酸反应产生气泡的快慢,构成原电池时负极比正极活泼,置换反应,金属离子在溶液中电解时的现象等。甲同学用两种金属放到酸中是否产生气泡或产生气泡的快慢来比较。乙同学在甲的基础上,加入CuSO4溶液观察现象,锌与少量硫酸铜发生置换反应生成的铜附在锌表面形成微型原电池,加快了反应速率,产生气泡的速率加快,说明锌比铜活泼。丙同学在乙同学的基础上运用电解原理,阴极有红色的铜析出说明锌比铜活泼。最后要设计一种方案,可以从氧化还原反应的先后顺序去证明金属的活泼性,即与同种氧化剂接触时,活泼性强的金属先与氧化剂反应,活泼性弱的金属后与氧化剂反应,因此可以将锌、铜分别同时加入到少量浅绿色的氯化亚铁溶液中,加入锌的溶液褪色,说明锌比铜活泼。
答案:(1)锌片上有气泡产生,铜片上无气泡 锌能置换出酸中的氢,而铜不能
(2)CuSO4 锌片上有红色的铜析出,锌片上产生气泡的速率明显加快 活泼金属可以把不活泼金属从其盐溶液中置换出来(或Zn、Cu、稀硫酸组成原电池,Zn为负极)
(3)CuSO4 2CuSO4+2H2O 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
阴极上有红色铜析出,阳极附近有气体产生
(4)分别取一小片铜片与锌片置于两支试管中,向试管中加入少量浅绿色的FeCl2溶液,片刻后,加锌片的试管中溶液的颜色褪去,溶液近乎无色(其他可行答案也可)


科目:高中化学 来源: 题型:
已知:A、B、C、D、E、F六种元素的核电荷数依次增大,属于周期表中前四周期的元素。其中A原子的核外有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有2对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F原子的M层电子排布式为________________。
(2)B、C、D的第一电离能由小到大的顺序为________________________________________________________________________
(用元素符号表示)。
(3)A的简单氢化物分子极易溶于水,其主要原因是____________________________________。
(4)E的最高价氧化物分子的空间构型是____________,其中心原子的杂化方式为__________。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为________。
(6)A、F形成的某种化合物的晶胞结构如图K348所示,则其化学式为________(黑色球表示F原子);已知紧邻的白球与黑球之间的距离为a cm,则该晶胞的密度为__________g/cm3。

图K348
查看答案和解析>>
科目:高中化学 来源: 题型:
在宏观—微观—符号之间建立联系,是化学学科特有的思维方式。汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”便可以使汽车的尾气转换成无毒气体。如用 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:
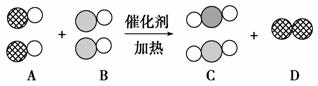
(1)A、B、C三种物质可以归为一类的依据是_____________________________________________________________
_________________________________________________________。
(2)将C归为化合物,将D归为单质的理由是_____________________________________________________________
_______________________________________________________。
(3)用化学反应方程式表示为_________________________________________________________________
_____ ____________________________________________________。
____________________________________________________。
化学变化过程中消耗的A物质和生成的C物质的质量比为____________。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池的电池反应为:Fe+2Fe3+===3Fe2+,与此电池反应不符的原电池是( )
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片、锌片、Fe2(SO4)3溶液组成的原电池
D.铜片、铁片、Fe(NO3)3溶液组成的原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
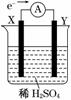 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为铁和碳棒,则X为碳棒,Y为铁
C.X极上发生的是氧化反应,Y极上发生的是还原反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
已知空气-锌电池的电极反应:
锌片:Zn-2OH--2e- = ZnO + H2O,石墨:1/2 O2+H2O +2e- = 2OH-
据次推断锌片是
A、负极,被氧化 B、负极,被还原 C、正极,被氧化 D、正极,被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
铬是一种重金属,铬超标对环境和人类有很大的危害,高价态铬对人体的毒性非常强,对肝、肾等内脏器官和DNA造成损伤,在人体内蓄积具有致癌性并可能诱发基因突变等。
(1)某电镀厂用生铁将废水中的Cr2O72-转化为Cr3+,并进一步从废水中除去,其流程图如下:

① 气体A是 。
② 在上述酸性溶液中,生铁比纯铁产生Fe2+的速率快,原因是 。
③ 将Cr3+转化为Cr(OH)3的离子方程式是 。
(2)电解法将一定浓度的酸性废水中的Cr2O72-转化为Cr3+,其原理示意图如下:

① 阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式是 。
② 一段时间后,试管底部出现沉淀。解释生成沉淀的原因:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com