
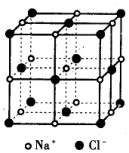
 已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )| A. | 117α3ρ | B. | $\frac{M}{N{α}^{3}}$ | C. | $\frac{234}{{α}^{3}ρ}$ | D. | $\frac{58.5}{2{α}^{3}ρ}$ |
分析 图中Na+与最邻近的Cl-的核间距离为a cm,则立方体的棱长为2acm,由图可知,Na+位于棱心和体心,Cl-位于顶点和面心,结合ρ=$\frac{m}{V}$计算.
解答 解:图中Na+与最邻近的Cl-的核间距离为a cm,则立方体的棱长为2acm,晶胞体积为(2a)3cm3,
由图可知,Na+位于棱心和体心,其个数为12×$\frac{1}{4}$+1=4,Cl-位于顶点和面心,其个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,NaCl的摩尔质量为58.5g•mol-1,则晶胞质量为$\frac{58.5×4}{{N}_{A}}$g,
食盐晶体的密度为ρg•cm-3,可知ρg•cm-3=$\frac{\frac{58.5×4}{{N}_{A}}g}{(2a)^{3}c{m}^{3}}$,解得NA=$\frac{58.5}{2{a}^{3}ρ}$,
故选D.
点评 本题考查晶胞计算,为高频考点,把握晶胞中原子的位置、均摊法计算为解答的关键,侧重分析与应用能力的考查,注意晶体的结构,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在白磷(P4)晶体中,P原子与P-P键数目比为2:3 | |
| B. | 分子晶体中都存在范德华力,分子内都存在共价键 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用.
如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用.| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.
甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余,得100mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸在酯化反应中只起催化剂作用 | |
| B. | 酯化反应是有限度的 | |
| C. | 酯化反应的机理是酸去羟基,醇去羟基上的氢原子 | |
| D. | 酯化反应也属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78,5 | 132 | 34-6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+的结构示意图: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | H2O2的电子式: | |
| D. | 小苏打的电离方程式:NaHCO3?Na++HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com