
(15分)按要求回答下列有关问题。
(1)据报道,科学家新研发出一种常温下催化合成NH3的方法:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
已知如下信息:
①化合物的生成热可以表示其相对能量。化学上,规定标准状况下稳定单质的生成热为0。几种物质的生成热:NH3(g)为mkJ·mol-1,H2O(l)为nkJ·mol-1。
反应的△H=产物的生成热之和---反应物的生成热之和
②几种化学键的键能数据如下:

上述反应中,△H=_______kJ·mol-1,H-N键的键能为_______kJ·mol-1。
(2)二氧化硫在一定条件下可以发生如下反应:
SO2(g)+NO2(g) SO3(g)+NO(g),△H= -42kJ·mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
SO3(g)+NO(g),△H= -42kJ·mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)=_____________________;
②实验丙中,达到平衡时,NO2的转化率为____________;
③由表中数据可推知,Tl______T2(填“>”“<’’或“=”);
(3)对反应N2O4(g) 2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
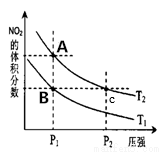
a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A深,C浅
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A=C
(4)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN-(N为-3价,下同),装置如图所示,通电过程中,阳极区两种离子的放电产物会进一步发生反应,其方程式为:C12+CNO-+OH-→□+Cl-+CO32-+H2O(未配平)。最终阴、阳两极均有无色无味气体产生。
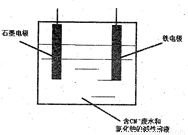
①铁电极应连接直流电源的____________(填写电极名称)。
②上述反应方程式配平后“□”内应填写________;
③阳极上发生的电极反应为2Cl--2e-=Cl2↑和_______________;
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:选择题
中和热测定的实验中不需使用的仪器有
①大、小烧杯; ②容量瓶; ③量筒; ④环形玻璃搅拌棒;
⑤试管; ⑥温度计; ⑦蒸发皿; ⑧托盘天平
A.①②⑥⑦ B.②⑤⑦⑧ C.②③⑦⑧ D.③④⑤⑦
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月模拟四理综化学试卷(解析版) 题型:选择题
战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是
A.CaO B.NaHCO3 C.SiO2 D.CaCO3
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三下学期猜题理综化学试卷(解析版) 题型:填空题
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
(1)高温固相法是磷酸铁锂生产的主要方法。通常以铁盐、磷酸盐和锂盐为原料,按化学计量比充分混匀后,在惰性气氛的保护中先经过较低温预分解,再经高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O4•2H2O+2NH4H2PO4═2NH3↑+3CO2↑+______+_______+_______
①完成上述化学方程式.
②理论上,反应中每转移0.15mol电子,会生成LiFePO4______________g;
③反应需在惰性气氛的保护中进行,其原因是______________;
(2)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
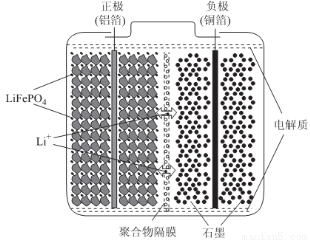
电池工作时的总反应为:LiFePO4+6C Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
(3)用该电池电解精炼铜。若用放电的电流强度I=2.0A的电池工作10分钟,电解精炼铜得到铜0.32g,则电流利用效率为______________(保留小数点后一位)。(已知:法拉第常数F=96500C/mol,电流利用效率= 100%)
100%)
(4)废旧磷酸亚铁锂电池的正极材料中的LiFePO4难溶于水,可用H2SO4和H2O2的混合溶液浸取,发生反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三下学期猜题理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值。下列说法中正确的有儿项( )
①1L0.1mol/LK2Cr2O7溶液中Cr2O72-的数目小于0.1NA
②1molCl2做氧化剂时得到的电子数为2NA
③25℃时,1LpH=12的碳酸钠溶液中含有Na+的数目为0.02NA
④过氧化钠与水反应时,生成0.5molO2转移的电子数为2NA
⑤50mL18.4mol/L的浓硫酸与足量的铜微热后反应,生成SO2分子数小于0.46NA
⑥利用氰尿酸与次氯酸在一定pH下反应可制备三氯异氰尿酸(结构如图).若原料完全反应,得到1mol产物同时生成3NA个H2O
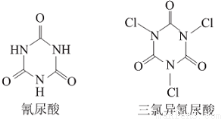
A.2 C.4 B.3 D.5
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三高考打靶测试理综化学试卷(解析版) 题型:选择题
全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是( )
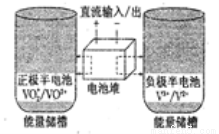
A.放电时,右槽发生还原反应
B.放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C.充电时,每转移1mol电子,n(H+)的变化量为1mol
D.充电时,阴极电解液pH升高
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三全真模拟理综化学试卷(解析版) 题型:填空题
【化学选修2:化学与技术】硝酸铵可用作化肥、军用炸药、杀虫剂、冷冻剂等。工业制取硝酸铵的工艺流程如下:

(1)合成氨气的工业设备名称_______________,设备中设置热交换器的目的是____________,合成氨的原料气必须先脱硫,目的是_______________;
(2)吸收塔中反应的化学方程式为_________________________,从生产流程看,吸收塔中需要补充空气,其原因是_______________;
(3)生产硝酸的过程中常会产生氮的氧化物,可用如下三种方法处理:
方法一:碱性溶液吸收法
NO+NO2+2NaOH═2NaNO2+H2O;2NO2+Na2CO3═NaNO2+NaNO3+CO2
方法二:NH3还原法
8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H=-2635kJ/mol(NO也有类似的反应)
方法三:甲烷吸收法
CH4(g)+2NO2═CO2(g)+N2+2H2O(g)△H=+867kJ/mol(NO也有类似的反应)
上述三种方法中,方法一的主要缺点是_______________;
方法三和方法二相比,方法三的缺点是_______________;
(4)工业上也可以通过电解NO制备NH4NO3,其工作原理如图所示.

①图中通入NH3的目的是_______________;
②若维持电流强度为3A,电解2小时,理论上可制得NH4NO3的最大质量为_____g;(已知F=96500C•mol-l)(保留2位有效数字).
(5)某化肥厂用NH3制备NH4NO3.己知:NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其他损耗)的百分比为______________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三考前热身理综化学试卷(解析版) 题型:选择题
常温下,向10ml 0.1 mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
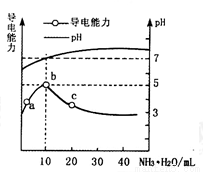
A.a~b点导电能力增强,说明HR为弱酸
B.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
C.b点溶液pH=5,此时酸碱恰好中和
D.b~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
某有机物其结构简式如图关于该有机物,下列叙述不正确的是 ( )
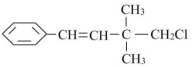
A.能与NaOH的醇溶液共热发生消去反应
B.能使溴水褪色
C.一定条件下,能发生加聚反应
D.一定条件下,能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com