
| A. | HI | B. | NaOH | C. | Br2 | D. | NaCl |
分析 含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,据此分析解答.
解答 解:A.HI分子中H-I原子之间只存在共价键,为共价化合物,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,为离子化合物,故B错误;
C.溴分子中Br-Br原子之间只存在共价键,为单质,故C错误;
D.氯化钠中钠离子和氯离子之间只存在离子键,为离子化合物,故D正确;
故选D.
点评 本题考查化学键和化合物类型判断,为高频考点,侧重考查基本概念,明确概念间的区别和联系是解本题关键,注意不能根据是否含有金属元素判断离子键,为易错点.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
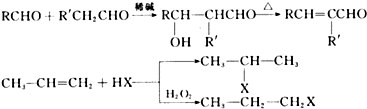


 .W有多种同分异构体,其中:①分子中有苯环,且苯环上的一溴代物有两种;②其水溶液遇FeCl3溶液呈紫色.则其可能的结构简式为(写两种):
.W有多种同分异构体,其中:①分子中有苯环,且苯环上的一溴代物有两种;②其水溶液遇FeCl3溶液呈紫色.则其可能的结构简式为(写两种): 、
、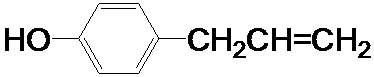
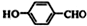 为原料制取液晶材料的中间体
为原料制取液晶材料的中间体  的合成路线图.
的合成路线图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、蛋白质、橡胶、油脂都是天然高分子化合物 | |
| B. | 加热会使蛋白质变性,因此食生鸡蛋所获营养价值高 | |
| C. | 通过灼烧时产生的气味可以鉴别蚕丝和棉纱 | |
| D. | 检验淀粉在稀硫酸催化下水解程度的方法是:取适量水解液于试管中,加入少量碘水,若出现蓝色说明没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 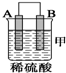 | 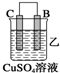 | 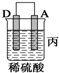 |
| 现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、OH- | B. | Ba2+、NO3-、SO42- | C. | K+、Na+、NO3- | D. | K+、NH4+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
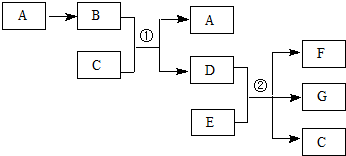
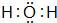 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
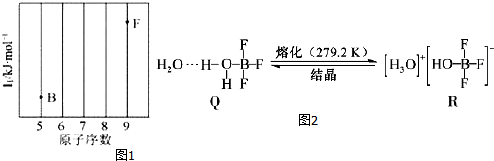
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com