
分析 ①将部分粉末加入水中,溶液呈无色,说明一定不含有CuSO4;振荡,有白色沉淀生成,说明一定含有Ba(NO3)2、Na2CO3生成碳酸钡白色沉淀;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,证明是碳酸钡沉淀;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀,以此来解答.
解答 解:①将部分粉末加入水中,溶液呈无色,说明一定不含有CuSO4;振荡,有白色沉淀生成,说明一定含有Ba(NO3)2、Na2CO3生成碳酸钡白色沉淀;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,证明是碳酸钡沉淀;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀,
(1)由上述分析可知,①说明溶液中一定没有Cu2+,故答案为:Cu2+;
(2)由上述分析可知,原白色粉末中一定含有的物质是Ba(NO3)2、Na2CO3,一定不含有的物质是CuSO4,故答案为:Ba(NO3)2、Na2CO3;CuSO4;
(2)①固体混合得到白色沉淀和无色溶液,一定不含有CuSO4,生成沉淀的是Ba(NO3)2、Na2CO3,生成的碳酸钡沉淀,反应的离子方程式为Ba2++CO32-=BaCO3↓,
故答案为:Ba2++CO32-=BaCO3↓;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,是碳酸钡沉淀溶于稀硝酸生成二氧化碳气体,反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及现象等为解答的关键,侧重分析与推断能力的考查,题目难度不大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:解答题
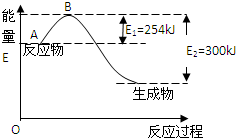 氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:
氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:| 化学键 | H-H | N≡N |
| 键能/( kJ/mol) | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | c电极的名称为正极,d电极上的电极反应式为CH4-8e-+4O2-═CO2+2H2O | |
| B. | 如图2所示,a电极上的电极反应式为4OH--4e-═2H2O+O2↑ | |
| C. | 如图2所示电解100mL0.5mol/LCuSO4溶液,若a电极产生56mL(标准状况)气体,则所得溶液的pH=1(不考虑溶液体积变化) | |
| D. | 若要使电解质溶液恢复到电解前的状态,可加入Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 霞石是一种硅酸盐,其组成可表示为K2O•3Na2O•4Al2O3•8SiO2.某小组同学设计以霞石为原料制备Al2O3的方案如下:
霞石是一种硅酸盐,其组成可表示为K2O•3Na2O•4Al2O3•8SiO2.某小组同学设计以霞石为原料制备Al2O3的方案如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com