
| A、缩小体积使压强增大 |
| B、降低体系温度 |
| C、体积不变充入He使气体压强增大 |
| D、保持总压强不变,充入Ne气体 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、①②③ |
| C、①④ | D、①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| B、饱和小苏打溶液中:c(Na+)=c(HCO3-) |
| C、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小 |
| D、室温下,对于0.10 mol?L-1的氨水,用HNO3溶液完全中和后,溶液不显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
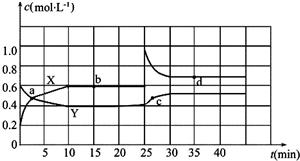
查看答案和解析>>
科目:高中化学 来源: 题型:
 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(SO2):n(SO3)=2:3 |
| B、V(SO2):V(SO3)=3:2 |
| C、m(SO2):m(SO3)=6:5 |
| D、Mr(SO2):Mr(SO3)=5:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com