
分析 (1)①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,酸中氢离子的物质的量与生成二氧化碳的体积成正比;
②在同体积、同浓度的三种酸中,醋酸和盐酸的物质的量相等,小于硫酸中氢离子的物质的量,酸中氢离子的物质的量与生成二氧化碳的体积成正比;
(2)①由HClO:K=4.8×10-11;H2CO3:K1=4.4×10-7,K2=4.7×10-11,因为:4.8×10-11>4.7×10-11,所以少量CO2与NaClO溶液反应只能生成碳酸氢钠和次氯酸;
②由H2CO3:K1=4.4×10-7,K2=4.7×10-11;H3PO4:K1=7.1×10-3,K2=6.3×10-8,K3=4.2×10-13,因为:7.1×10-3>4.4×10-7>6.3×10-8,所以过量CO2与Na2HPO4溶液反应只生成磷酸二氢根离子;
③由H2CO3:K1=4.4×10-7,K2=4.7×10-11;H3PO4:K1=7.1×10-3,K2=6.3×10-8,K3=4.2×10-13,因为:7.1×10-3>4.4×10-7>6.3×10-8,所以少量H3PO4与NaHCO3溶液反应,磷酸只能发生第一步电离.
解答 解:醋酸和盐酸都是一元酸,醋酸是弱酸,盐酸是强酸,硫酸是二元强酸,所以醋酸中存在电离平衡,氯化氢和硫酸完全电离,
(1)①同体积、同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,分别加入足量的碳酸钠粉末,氢离子的物质的量越大,生成的二氧化碳体积越大,硫酸和盐酸中生成的二氧化碳体积相同,醋酸中生成的二氧化碳体积最大,所以在相同条件下产生CO2的体积由大到小的顺序是c>a=b,
故答案为:c>a=b;
②在同体积、同浓度的三种酸中,醋酸和盐酸的物质的量相等,小于硫酸中氢离子的物质的量,则硫酸放出的二氧化碳体积最大,醋酸和盐酸中生成的二氧化碳体积相等,故答案为:b>a=c;
(2)①由HClO:K=4.8×10-11;H2CO3:K1=4.4×10-7,K2=4.7×10-11,因为:4.8×10-11>4.7×10-11,所以少量CO2与NaClO溶液反应只能生成碳酸氢钠和次氯酸,则离子方程式为:CO2+ClO-+H2O=HClO+HCO3-,故答案为:CO2+ClO-+H2O=HClO+HCO3-;
②由H2CO3:K1=4.4×10-7,K2=4.7×10-11;H3PO4:K1=7.1×10-3,K2=6.3×10-8,K3=4.2×10-13,因为:7.1×10-3>4.4×10-7>6.3×10-8,所以过量CO2与Na2HPO4溶液反应只生成磷酸二氢根离子,离子反应方程式为:CO2+HPO42-+H2O=H2PO4-+HCO3-,故答案为:CO2+HPO42-+H2O=H2PO4-+HCO3-;
③由H2CO3:K1=4.4×10-7,K2=4.7×10-11;H3PO4:K1=7.1×10-3,K2=6.3×10-8,K3=4.2×10-13,因为:7.1×10-3>4.4×10-7>6.3×10-8,所以少量H3PO4与NaHCO3溶液反应,磷酸只能发生第一步电离,所以反应方程式为:H3PO4+HCO3-=CO2+H2O+H2PO4-,故答案为:H3PO4+HCO3-=CO2+H2O+H2PO4-.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点、物质间的反应即可解答,难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅在高温下 | B. | 在任何温度下都不能自发进行 | ||
| C. | 在任何温度下 | D. | 仅在低温下 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
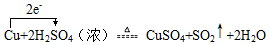 .实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.
.实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )| A. | 若不改变温度,减小压强使乙苯转化率和反应速率都减小 | |||||||||||
| B. | 已知
| |||||||||||
| C. | A、B两点对应的平衡常数大小:KA<KB | |||||||||||
| D. | 投料比的大小顺序:M1<M2<M3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com