
分析 (1)燃烧反应均为放热反应,C与水蒸气的反应为吸热反应;
(2)根据盖斯定律可知,反应一步完成或分步完成,其热效应相同;
(3)由盖斯定律可知:①=②+③+④,反应热也进行相应的计算.
解答 解:(1)因为燃烧反应均为放热反应,①③④为燃烧反应,属于放热反应,△H<0,②为吸热反应,△H>0;
故答案为:②;
(2)由盖斯定律可知,反应一步完成或分步完成,其热效应相同,则等质量的煤分别通过以上两条不同的途径产生的可利用的总能量相同,
故答案为:B;
(3)由盖斯定律可知,反应一步完成或分步完成,其热效应相同,所以①=②+③+④,则能量为E1=E2+E3+E4,即E4=E1-E2-E3,
故答案为:E4=E1-E2-E3.
点评 本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,为高频考点,侧重在于学生的分析能力的考查,题目较简单,注重基础知识的考查.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第1次 | 20.00 | 4.10 | 29.10 |
| 第2次 | 20.00 | 0.00 | 24.90 |
| 第3次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
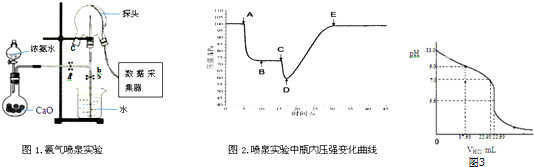
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | 溶解度 /(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
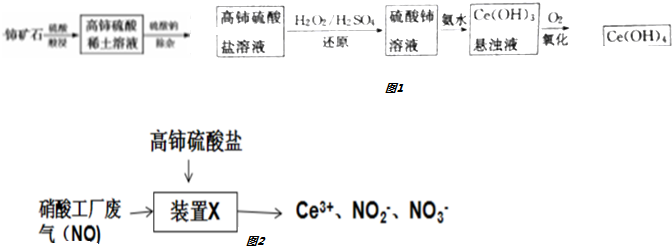
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
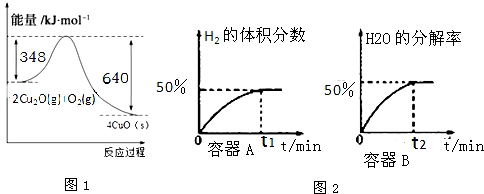
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CH3COOH溶液做导电实验,灯泡很暗,证明CH3COOH是弱电解质 | |
| B. | pH相同的醋酸和盐酸,取等体积的两种酸溶液分别稀释至原溶液体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m<n | |
| C. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小且c(NH4+)/c(NH3•H2O)的值增大 | |
| D. | 常温下,CH3COOH的Ka=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O的溶液中的c(OH-)相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com