
����Ŀ��ijС����ʵ��I��֤Fe2(SO4)3��Cu�ķ�Ӧ���۲쵽���쳣�����������������̽����
ʵ��I��
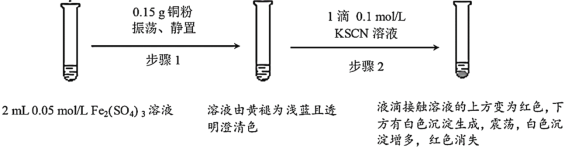
��1��Fe2(SO4)3��Һ�����³����Ե�ԭ����___��
��2��Fe2(SO4)3��KSCN��Һ��Ӧ�����ӷ���ʽΪ___��
��3��ʵ��ǰ��С��ͬѧԤ�⾭������2����Һ��Ӧ�ó��ֺ�ɫ��������__��
��4��ʵ��С���ɫ�����IJ�������������̽��
�������ϣ�i.CuSCNΪ������ˮ�İ�ɫ���塣
ii.SCN-����Ϊ��±�����ӣ�������±����������
����ʵ��ⶨ��ɫ����ΪCuSCN���������Ϻ�С��ͬѧ�²�CuSCN���������������ֿ���
�²�1��Cu2+��KSCN������������ԭ��Ӧ
�²�2���������ӽ��仹ԭCu2++Fe2+=Cu++Fe3+��Cu++SCN-=CuSCN��
Ϊ֤ʵ����С��ͬѧ����ʵ��II��III����FeSO4��CuSO4��ҺŨ��Ϊ0.1mol/L��KSCN��ҺŨ��Ϊ0.4mol/L��
ʵ����� | �Ա�ʵ�鼰�Լ� | ʵ�鲽�� | ʵ������ |
II |
| ����1mLKSCN��Һ | ��ʼʱ��Һ���Ϸ���Ϊ��ɫ��һ��ʱ����ɫ�������ӣ���������֧�Թ� |
| ����1mLKSCN��Һ | ��Һ�����ɫ |
�ٲ²�1�����ӷ���ʽ____��
��ʵ��II���Թ�__������ĸ���е��������֤ʵ�²�1��������
ʵ����� | �Ա�ʵ�鼰�Լ� | ʵ�鲽�� | ʵ������ |
| ����2mLCuSO4��Һ | ��Һ��Ϊ����ɫ | |
�ټ���1mLKSCN��Һ | ��Һ���ϲ��Ϊ��ɫ���а�ɫ����������һ��ʱ�����֧�Թ���Һ�ʺ�ɫ | ||
| ����4mLCuSO4��Һ | ��Һ��Ϊ����ɫ | |
�ټ���1mLKSCN��Һ | ��Һ���ϲ��Ϊ��ɫ���а�ɫ����������һ��ʱ�����֧�Թ���Һ��dz��ɫ | ||
| ����2mLCuSO4��Һ | ��Һ��Ϊ����ɫ | |
�ټ���1mLKSCN��Һ | ��Һ���ϲ��Ϊ��ɫ���а�ɫ����������һ��ʱ�����֧�Թ���Һ�����ɫ |
��5��Fe3+�������Ա�Ӧǿ��Cu2+�����ʵ��III�е��������Cu2++Fe2+=Cu++Fe3+����������ԭ����___��
��6��ʵ��С��������ϲ����ۺ�ó�����Һ�������ڷ�Ӧʱ�����ֵ�������ǿ������Ӧ��ԭ����ļ�̬��״̬�йء��ɴ˷�������CuSCN����ʹCu2+����������ǿ��������ʵ���һ��֤���������ʵ����___��
���𰸡�Fe3++3H2O![]() Fe(OH)3+3H+��Fe3+ˮ��ʹ��Һ������ Fe3++3SCN-
Fe(OH)3+3H+��Fe3+ˮ��ʹ��Һ������ Fe3++3SCN-![]() Fe(SCN)3 ���ݷ�ӦCu+2Fe3+=Cu2++2Fe2+��Cu�۹�����Ӧ��Fe3+���� 2Cu2++4SCN-=2CuSCN��+(SCN)2 B ����SCN-��Cu+�γɳ����Լ�SCN-��Fe3+�γ���������˲�����Cu+��Fe3+��Ũ�ȣ�ʹ�ø÷�Ӧ��ƽ����������ƶ� ����ƶԱ�ʵ��
Fe(SCN)3 ���ݷ�ӦCu+2Fe3+=Cu2++2Fe2+��Cu�۹�����Ӧ��Fe3+���� 2Cu2++4SCN-=2CuSCN��+(SCN)2 B ����SCN-��Cu+�γɳ����Լ�SCN-��Fe3+�γ���������˲�����Cu+��Fe3+��Ũ�ȣ�ʹ�ø÷�Ӧ��ƽ����������ƶ� ����ƶԱ�ʵ��
�Ա�ʵ�鼰�Լ� | ʵ�鲽�� | ʵ������ |
2mL0.1mol/LFeSO4��Һ | ����4mL0.1mol/LCuSO4��Һ �ټ���1mL0.4mol/LKSCN��Һ | һ��ʱ�����֧�Թ���Һ�ʺ�ɫ |
2mL0.1mol/LFeSO4��Һ | ����4mL0.1mol/L CuSO4��Һ �ټ���1mL1mol/LKSCN��Һ | һ��ʱ�����֧�Թ���Һ����ɫ��F�Թ���ɫ���� |
Ҳ����Ƴ�ԭ���װ�ã�������ձ��е���1��Ũ�Ƚϴ�����軯����Һ���ڵ���ǰ�������¼��ѹ����������ƣ�ʾ���ı仯
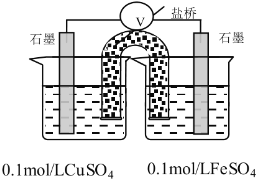
��������
Fe2(SO4)3 ����ǿ�������Σ�Fe3+����ˮ���ʹ��Һ�����ԡ�����ƽ���ƶ�ԭ����Ӱ�컯ѧƽ���ƶ������ؽ��з�����
��1��Fe2(SO4)3 ����ǿ�������Σ�Fe3+����ˮ���ʹ��Һ�����ԣ���Fe2(SO4)3��Һ�����³����Ե�ԭ���ǣ�Fe3++3H2O![]() Fe(OH)3+3H+��Fe3+ˮ��ʹ��Һ�����ԡ�
Fe(OH)3+3H+��Fe3+ˮ��ʹ��Һ�����ԡ�
��2��Fe2(SO4)3��KSCN��Һ��Ӧ����Һ��ΪѪ��ɫ���÷�Ӧ�����ӷ���ʽΪFe3++3SCN-![]() Fe(SCN)3��
Fe(SCN)3��
��3��ʵ��ǰ��С��ͬѧԤ�⾭������2����Һ��Ӧ�ó��ֺ�ɫ�������ǣ�������ӦCu+2Fe3+=Cu2++2Fe2+��Fe3+�����ʵ���Ϊ0.0001mol��Cu�����ʵ���ԼΪ0.002mol��Cu�۹���,��Ӧ��Fe3+���ڡ�
��4����SCN-����Ϊ��±�����ӣ�������±���������ƣ������л�ԭ�ԣ�Cu2+�������ԣ���ɫ����ΪCuSCN��Cu2+��KSCN������������ԭ��Ӧ�������ӷ���ʽΪ2Cu2++4SCN-=2CuSCN��+(SCN)2��
��ʵ��II�У��Թ�B�е�CuSO4��Һ�м���KSCN��Һ����Һ�����ɫ��������Ϊû�а�ɫ�������ɣ��ʿ���֤ʵ�²�1��������
��5��Fe3+�������Ա�Ӧǿ��Cu2+�����ʵ��III�е��������Cu2++Fe2+=Cu++Fe3+����������ԭ���ǣ�����SCN-��Cu+�γɳ����Լ�SCN-��Fe3+�γ���������˲�����Cu+��Fe3+��Ũ�ȣ�ʹ�ø÷�Ӧ��ƽ����������ƶ���
��6��ʵ��С��������ϲ����ۺ�ó�����Һ�������ڷ�Ӧʱ�����ֵ�������ǿ������Ӧ��ԭ����ļ�̬��״̬�йء��ɴ˷�������CuSCN����ʹCu2+����������ǿ��������ʵ���һ��֤�������ݿ��Ʊ�������������Һ��SCN-��Ũ�ȣ�ʹ��CuSCN�ij����ܽ�ƽ������������ƶ�������ƶԱ�ʵ�����£�
�Ա�ʵ�鼰�Լ� | ʵ�鲽�� | ʵ������ |
2mL0.1mol/LFeSO4��Һ | ����4mL0.1mol/LCuSO4��Һ �ټ���1mL0.4mol/LKSCN��Һ | һ��ʱ�����֧�Թ���Һ�ʺ�ɫ |
2mL0.1mol/LFeSO4��Һ | ����4mL0.1mol/L CuSO4��Һ �ټ���1mL1mol/LKSCN��Һ | һ��ʱ�����֧�Թ���Һ����ɫ��F�Թ���ɫ���� |
Ҳ����Ƴ�ԭ���װ�ã�������ձ��е���1��Ũ�Ƚϴ�����軯����Һ���ڵ���ǰ�������¼��ѹ����������ƣ�ʾ���ı仯
 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᡢ���ᡢ��������ᶼ��ǿ�ᣬ��������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣�����±�����ӱ������ж�����˵������ȷ���ǣ� ��
�� | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6��10��5 | 6.3��10��9 | 1.6��10��9 | 4.2��10��10 |
A.�ڱ��������������ᶼû����ȫ����
B.�ڱ������и�������������������ǿ����
C.�ڱ�����������ĵ��뷽��ʽΪH2SO4=2H����SO42-
D.ˮ�������������ǿ��û����������������������������������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��mA��g����nB��g��![]() pC��g�����ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
pC��g�����ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
��1���÷�Ӧ���淴ӦΪ________��Ӧ����������������������������m��n________p������>��������������<������
��2����ѹʹ�����������ʱ��A����������__________��������������������С����������������ͬ��
��3��������B��ά���������������A��ת����____________��
��4���������¶ȣ���ƽ��ʱB��C��Ũ��֮�Ƚ�____________��
��5�������������ƽ��ʱ��������������ʵ���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ C(s)+ H2O (g) ![]() CO (g)+H2 (g) ��H��0 ��ijһʱ����з�Ӧ�����뷴Ӧ���̵����߹�ϵ��ͼ������˵����ȷ���ǣ� ��
CO (g)+H2 (g) ��H��0 ��ijһʱ����з�Ӧ�����뷴Ӧ���̵����߹�ϵ��ͼ������˵����ȷ���ǣ� ��

A.CO�����������ߵ�һ��ʱ��Ϊt5-t6
B.t2-t3��t3-t4ʱ���H2������������
C.t1ʱ�̸ı�������ǽ����¶�
D.t4-t5ʱ���ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨ0.1mol��L-1Na2SO3��Һ�������ٽ��¹����е�pH���������±���ʵ������У�ȡ�١���ʱ�̵���Һ�����������ữ��BaCl2��Һ���Ա�ʵ�飬�ܲ�����ɫ�����ࡣ����˵������ȷ���ǣ� ��
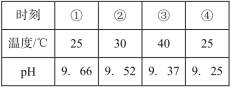
A.Na2SO3��Һ�д���ˮ��ƽ�⣺SO32-+H2O![]() HSO3-+OH-
HSO3-+OH-
B.�ܲ����İ�ɫ������BaSO4
C.�����۵Ĺ����У�c(SO32-)�ڽ���
D.�����۵Ĺ����У��¶���c(SO32-)��ȣ�ǰ�߶�ˮ��ƽ���Ӱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��ҺW�����������е���������ɣ�H����![]() ��Fe3����Ba2����Mg2����
��Fe3����Ba2����Mg2����![]() ��I����OH����
��I����OH����![]() ����W�м������ۺ�������Y������Ԫ�ص�����X�����ɡ���������ˮ�ĵ��룬������˵������ȷ����
����W�м������ۺ�������Y������Ԫ�ص�����X�����ɡ���������ˮ�ĵ��룬������˵������ȷ����
A.Xһ����Al3��B.Yһ����H2
C.W����ຬ��6������D.��Һ�в����ܺ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȡ�Ļ�ѧ����ʽ�У�������������ԭ��Ӧ����(����)
A.ʵ������ȡ������Zn��H2SO4=ZnSO4��H2��
B.ʵ������ȡ������̼��CaCO3��2HCl=CaCl2��H2O��CO2��
C.ʵ������ȡ������MnO2��4HCl(Ũ)![]() MnCl2��2H2O��Cl2��
MnCl2��2H2O��Cl2��
D.��ҵ����ȡ�������ȣ�2NaClO3��4HCl(Ũ)=2NaCl��2H2O��2ClO2����Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3L���ܱ������У�������Ӧ��CO(g)+2H2(g)![]() CH3OH(g)���ڲ�ͬ�¶��¼״������ʵ�����ʱ��ı仯��ͼ��ʾ������������ȷ����
CH3OH(g)���ڲ�ͬ�¶��¼״������ʵ�����ʱ��ı仯��ͼ��ʾ������������ȷ����

A. ƽ�ⳣ��K(300 ��)<K(500 ��)
B. ��������������ʱ��ѹ������E�����ϵ���������Ũ������
C. 300 �棬�������������ܶȲ���ʱ˵����Ӧ�Ѿ��ﵽƽ��
D. 500 �棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=![]() mol��L1��min1
mol��L1��min1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4molSO2��2molO2�Ļ��������������ɱ�ĺ�ѹ�����У���һ�������·������·�Ӧ2SO2(g)+ O2(g)![]() 2SO3(g) ��H<0���÷�Ӧ��ƽ��ʱ,������������ʵ���Ϊ4.2mol���Իش�
2SO3(g) ��H<0���÷�Ӧ��ƽ��ʱ,������������ʵ���Ϊ4.2mol���Իش�
��1���ڸ�ƽ��ʱ��n(SO3)=_____mol
��2������ʼʱ����1.2molSO2��0.6molO2��xmolSO3���ﵽƽ��ʱ�������������������ƽ��״̬��ͬ����x��ȡֵ��Χ��________
��3������Ӧ��ʼʱv(��)> v(��),�ﵽ����ƽ��״̬ʱ,����������ʵ�����Ϊ4.2mol������ʼʱn(SO3)��ȡֵ��Χ��______
��4������Ӧ������SO2��O2��SO3���ʵ����仯��ͼ��ʾ����Ӧ������20minʱ�����߷����仯��ԭ����______________________�������ֱ����10 min��15 min�����߱仯��ԭ�������_________(��д���)��

A�����˴��� | B����С������� |
C�������¶� | D������SO3�����ʵ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com