
 (1)25℃时,下列4种溶液.请回答下列问题.
(1)25℃时,下列4种溶液.请回答下列问题.| 物质 | H3PO2 | H2S | 一元酸HA |
| Kn | Kn=5.9×l0-2 | Kn1=9.1×l0-8 Kn2=l.l×l0-12 | Kn=l.1×1O-10 |
分析 (1)一水合氨和醋酸是弱电解质,NaOH与HCl是强电解质,弱电解质在水溶液中不能完全电离,存在电离平衡,强电解质能够完全电离,据此分析;
(2)弱酸的电离平衡常数越大,溶液酸性越强,其酸性由强到弱的顺序为H3PO2>H2S>HA>HS-,H3PO2只能够一步电离,说明其为一元酸;据质子守恒分析③.
解答 解:(1)一水合氨和醋酸是弱电解质,NaOH与HCl是强电解质,弱电解质在水溶液中不能完全电离,存在电离平衡,强电解质能够完全电离,
①氢离子和氢氧根离子对水的电离都有影响,上述4只溶液中,只有0.01 mol•L-1 氨水中氢氧根离子浓度最小,对水的电离的抑制程度最小,故答案为:A;
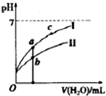
②相同pH的盐酸与醋酸加水稀释时,弱电解质醋酸的pH变化小,所以曲线I对应的溶液为盐酸;盐酸和醋酸都是一元酸,溶液中pH越小氢离子浓度越大,说明离子总浓度大,溶液导电能力越强,所以溶液导电能力由强到弱的顺序是b>a>c,故答案为:D;b>a>c;
③pH=2的CH3COOH溶液的浓度远远大于0.01mol/L,所以B、C溶液等体积混合,溶液显酸性,pH<7,故答案为:<;
(2)①H3PO2只能够一步电离,说明其为一元酸,其电离方程式为H3PO2?H2PO2-+H+,故答案为:H3PO2?H2PO2-+H+;
②弱酸的电离平衡常数越大,溶液酸性越强,其酸性由强到弱的顺序为H3PO2>H2S>HA>HS-,所以H2S溶液与NaA溶液反应生成HA和NaHS,化学方程式为H2S+NaA=NaHS+HA,故答案为:H2S+NaA=NaHS+HA;
③Na2S溶液中存在质子守恒,c(H+)+c(HS-)+2c(H2S)=c(OH-),pH=11的溶液中c(OH-)=1.0×10-3mol/L,故答案为:1.0×10-3mol/L.
点评 本题考查了强弱电解质的区别、据电离平衡常数判断弱酸的强弱,以及对弱电解质的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 盐酸、纯碱、氣酸钾、氧化镁、二氧化硅 | |
| B. | 硝酸、烧碱、次氯酸钠、氧化钙、二氧化硫 | |
| C. | 次氯酸、消石灰、硫酸铵、过氧化钠、二氧化碳 | |
| D. | 氨基酸、过氧化钠、碱式碳酸铜、氧化铁、一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
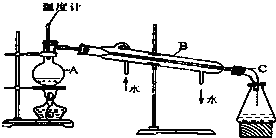 如图是某学生绘制的实验室蒸馏石油的装置图:
如图是某学生绘制的实验室蒸馏石油的装置图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2和CH3CH2Cl都属于烃 | B. | 乙烯和乙烷都能发生加聚反应 | ||
| C. | C3H6有三种同分异构体 | D. | 苯的硝化反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 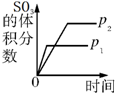 研究压强对反应的影响(p2>p1) | |
| B. |  研究温度对反应的影响 | |
| C. |  研究平衡体系中增加O2浓度对反应的影响 | |
| D. |  体积恒定的密闭容器中催化剂对反应的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 纤维素属于高分子化合物,与淀粉互为同分异构体 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 甲酸分子中有醛基,因此无法区別甲醛溶液和甲酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 实现化石燃料清洁利用,就无需开发新能源 | |
| C. | 废旧电池必须集中处理,以防止重金属污染 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维 | |
| B. | 在汽车排气管上加装尾气“催化转化器”可以有效减少有害气体的排放 | |
| C. | 气象环境报告中新增的“PM2.5”是对一种新分子的描述 | |
| D. | 为防止食品氧化变质,食品袋中放有硅胶包 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (Ⅰ)开发新型替代燃料成为各国关注的重要科研项目,中国现已成为世界第三大利用植物秸秆(主要成分纤维素)生产燃料乙醇的国家.写出乙醇燃烧的化学方程式:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O.
(Ⅰ)开发新型替代燃料成为各国关注的重要科研项目,中国现已成为世界第三大利用植物秸秆(主要成分纤维素)生产燃料乙醇的国家.写出乙醇燃烧的化学方程式:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com