
| A. | 石英和浓盐酸混合 | B. | 水玻璃中通入二氧化碳 | ||
| C. | 硅藻土和浓烧碱共热 | D. | 二氧化硅和氢氟酸混合 |
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:实验题
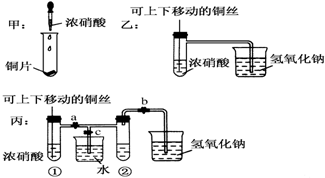
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,其中含有的化学键类型是(极性)共价键
,其中含有的化学键类型是(极性)共价键查看答案和解析>>
科目:高中化学 来源: 题型:选择题
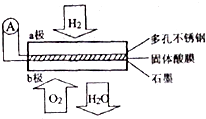 某固体燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )| A. | 电池工作时,化学能主要转化为电能 | |
| B. | b极上的电极反应式为:O2+4H++4e-=2H2O | |
| C. | 每转移0.4mol电子,生成3.6g水 | |
| D. | H+由b极通过固体酸电解质传递到a极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只由非金属元素组成的离子不一定都是阴离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 某元素从化合态变为游离态,该元素一定被还原 | |
| D. | 金属元素原子最外层电子数越少,金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (10b-5a)mol•L- | B. | (2b-a)mol•L- | C. | ($\frac{b}{10}$-$\frac{a}{20}$)mol•L- | D. | (5b-$\frac{5a}{2}$)mol•L- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com